Sterkt elektrolyttkonsept, egenskaper, eksempler

- 3603
- 105
- Theodor Anders Hopland
EN Sterk elektrolytt Det er alt det stoffet som oppløst i vann, eller i et spesifikt løsningsmiddel, er fullstendig dissosiert på ioner. Derfor skal det ikke være en løsning som nøytrale molekyler, eller som uoppløselige faste stoffer. En sterk elektrolytt kan være et salt, en syre eller en base, forutsatt at de dissosierer eller fullstendig ionisk.
Det mest representative eksemplet på en elektrolytt er vanlig salt, natriumklorid, NaCl. I vandig løsning dissosierer NaCl -krystaller i sin helhet for å produsere NA -ioner+ og cl-, som ender med å omgi vannmolekyler. Det sies da at et salt oppfører seg som en sterk elektrolytt når løseligheten er veldig høy i vann.
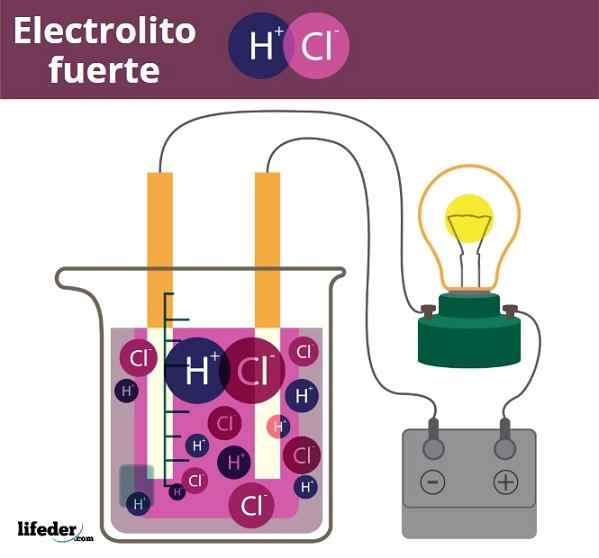 Fuero elektrolitteksempel. HCl, saltsyre, frigjør H3O+ og CL -ioner-
Fuero elektrolitteksempel. HCl, saltsyre, frigjør H3O+ og CL -ioner- Noe lignende er tilfellet med syrer og baser. Når disse er sterke, produserer løsningene deres i vann maksimal mulig mengde H -ioner3ENTEN+ eller åh-, Så pH -endringer er brå. Eksempler på sterke syrer og baser er salpetersyre, HNO3, og kaliumhydroksyd, henholdsvis KOH.
Det er viktig å vite hvordan man kan identifisere sterke elektrolytter når du tilbereder veldig ioniske løsninger, eller veldig sterk syre eller grunnleggende midler.
[TOC]
Kjennetegn på sterke elektrolytter
Løselighet
Sterke elektrolytter er preget av å være ekstremt oppløselige vannstoffer. Enten faste eller gasser, når du kommer i kontakt med vann, bør det ikke bli forsinket for mye å løse opp helt. Hvis et salt, for eksempel, er lite oppløselig i vann, kan det kastes som en sterk elektrolytt.
Ionisk konduktivitet
Sterke elektrolytter er ikke bare veldig løselige i vann, men genererer også et stort antall ioner. Takket være de elektriske ladningene til disse ionene, kan elektroner komfortabelt reise løsningene. Dette gjenspeiles i en økning i ionisk konduktivitet med hensyn til rent vann. Det er grunnen til at ioniske løsninger fører veldig godt strøm.
Kan tjene deg: klor: historie, egenskaper, struktur, risiko, brukSaltnøytralitet
Mange saltvanns sterke elektrolytter, når de oppløses i vann, produserer ikke pH -endring. Dette betyr at løsningene av disse saltene ikke er sure eller grunnleggende, men nøytrale, med en pH nær 7.
Imidlertid kan det være syre eller basiske salter som lett blir oppløst i vann, og som også genererer komplette ioner. For eksempel natriumkarbonat2Co3, oppløses for å generere Na -ioner+ og co32-, Men pH i løsningen er grunnleggende.
Eksempler på sterke elektrolytter
 Natriumklorid er det mest representative eksemplet på en sterk elektrolytt. Kilde: Cristian v. /CC By-SA (https: // creativecommons.Org/lisenser/by-SA/4.0)
Natriumklorid er det mest representative eksemplet på en sterk elektrolytt. Kilde: Cristian v. /CC By-SA (https: // creativecommons.Org/lisenser/by-SA/4.0) Sterke elektrolytter, som er så mange, er delt inn i tre klassifiseringer: sterke syrer, sterke baser og oppløselige salterprodukt av nøytraliseringer mellom de to første.
Sterke syrer
Sterke syrer når du løses opp i vann, uten problemer, må gi maksimal mulig mengde h3ENTEN+, så syre må være fullstendig ion; det vil si at det ikke skal eksistere som et nøytralt molekyl med syreprotoner uten å frigjøre.
Eksempler på disse syrene er:
-HCl, saltsyre, frigjør H -ioner3ENTEN+ og cl-
-HF, fluorhorinsyre, frigjør H -ioner3ENTEN+ og f-
-Hno3, Salpetersyre, frigjøring hones h3ENTEN+ og ikke3-
-Hclo4, perklorsyre, frigjør H -ioner3ENTEN+ og Clo4-
-HIO4, Periódinsyre, frigjør H -ioner3ENTEN+ og io4-
-H2SW4, svovelsyre, frigjøring hones h3ENTEN+ Og så42-
Årsaken til at hydriumionet, h3ENTEN+, Det er alltid til stede (en eller annen måte), det er fordi hydrogenet de donerer mottas av et vannmolekyl:
HCl + H2O → h3ENTEN+ + Cl-
Reaksjonen er direkte og irreversibel. Dette er et kjennetegn ved en sterk syre, som igjen er en sterk elektrolytt på grunn av sin fulle ionisering i vann.
Kan tjene deg: Alifatiske hydrokarboner: egenskaper, nomenklatur, reaksjoner, typerSterke baser
Sterke baser, oppløsning i vann uten problemer, må frigjøre OH -ioner- Fra de samme krystaller, eller irreversibelt uhemmet et vannmolekyl for å generere dem.
Mange sterke baser består av ion og ikke -molekylære faste stoffer. Noen eksempler på disse basene som oppfører seg som sterke elektrolytter er:
-Lioh, litiumhydroksyd, frigjør OH -ioner- og Li+
-NaOH, natriumhydroksyd, frigjør OH -ioner- og na+
-RBOH, Rubidio hydroxide, slipper OH -ioner- og RB+
-CA (OH)2, Kalsiumhydroksyd, frigjør OH -ioner- og ca2+
-Sr (OH)2, Strontiumhydroksyd, frigjør OH -ioner- og MR2+
-Ba (oh)2, bariumhydroksyd, frigjør OH -ioner- og ba2+
-Nah, natriumhydrid, frigjør OH -ioner- og hydrogengass, h2
-Nanh2, natrium amiduro, slipp Oh -ioner- og ammoniakkgass, NH3
Du går ut
Hallobasi sterke elektrolytter når det oppløses i vann må være fullstendig ion. Mange av dem produserer ikke pH -endringer. Dette er fordi ionene deres er veldig stabile, så de ikke deltar i hydrolysisaldoer for å endre vannets natur. Eksempler på disse saltene er:
-NaCl, natriumklorid, frigjør na -ioner+ og cl-
-Agno3, Sølvnitrat, frigjør agioner+ og ikke3-
-Eldre bror3, natriumnitrat, frigjør naioner+ og ikke3-
-K2SW4, Kaliumsulfat, frigjør k -ioner+ Og så42-
-Mgcl2, Magnesiumklorid, frigjør Mg -ioner2+ og cl-
-Cuso4, Kuprisk sulfat, frigjør ioner cu2+ Og så42-
-KBR, Kaliumbromid, frigjør K -ioner+ og Br-
-NH4CL, ammoniumklorid, frigjør NH -ioner4+, Cl-, H3ENTEN+ og ammoniakkgass
Det kan tjene deg: kvikksølvklorid (ii): struktur, egenskaper, innhenting, bruk-NACN, natriumcyanid, frigjør Na -ioner+ og CN-
-Na3Po4, natriumfosfat, frigjør na -ioner+ og po43-
-Crcl3, Kromklorid, frigjør CR -ioner3+ og cl-
-AUB3, Auric bromide, frigjør au -ioner3+ og Br-
-Snso4, Estany Sulfate, frigjør SN -ioner2+ Og så42-
NH4CL er et motstridende eksempel: det er fullstendig ionisert, men samtidig genererer det ammoniakknøytrale molekyler fordi det er et syresalt.
Forskjeller mellom sterk og svak elektrolytt
Selv om forskjellene mellom en sterk elektrolytt av en svak er blitt etablert indirekte, vil disse bli presentert nedenfor som en konklusjon:
-Sterke elektrolytter er veldig løselige i farvann; Svake elektrolytter er ikke.
-Ioniseringen av en svak elektrolytt er delvis, noe som betyr at det kan være nøytrale molekyler i løsning. I stedet eksisterer sterke elektrolytter utelukkende som ioner.
-De svake syrene og basene, som igjen er svake elektrolytter, dissosierer seg ikke helt i vann, så de genererer mindre ioner h3ENTEN+ eller åh- Hva kan forventes.
-Halth -halin Sterke elektrolytter er nesten ikke hydrolysert sammenlignet med svake elektrolytter. Derfor har løsningene til førstnevnte en tendens til å være nøytrale, bortsett fra når de takler syre- eller basissalter.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Sterk elektrolytt. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Sterk elektrolyttdefinisjon og eksempel. Gjenopprettet fra: Thoughtco.com
- Chung & Chieh. (5. juni 2019). Elektrolytter. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Eksterne evalueringskarakteristikker, typer (tester), eksempler
- Platon biografi, filosofi og bidrag »

