Begrensningsenzymer Funksjoner, typer og eksempler
- 2268
- 339
- Oliver Christiansen
De Begrensningsenzymer De er endonukleaser brukt av visse buer og bakterier for å hemme eller "begrense" forplantningen av virus inni. De er spesielt vanlige i bakterier og er en del av deres utenlandske DNA -forsvarssystem kjent som begrensnings-/modifikasjonssystemet.
Disse enzymene katalyserer dobbeltbånd -DNA -kuttet på bestemte steder, reproduserbar og uten bruk av ekstra energi. De fleste krever tilstedeværelse av kofaktorer som magnesium eller andre divalente kationer, selv om noen også krever ATP- eller S-adenosylmetionin.
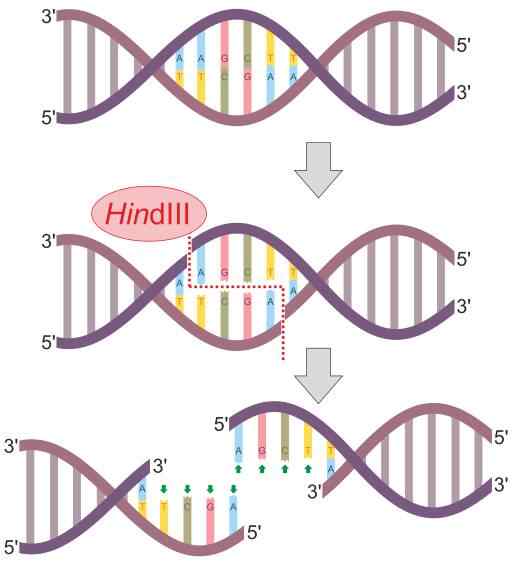
 Hindii Restriksjonsenzymreaksjonsskjema (Kilde: Helixitta [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Hindii Restriksjonsenzymreaksjonsskjema (Kilde: Helixitta [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) Begrensningsendonukleasene ble oppdaget i 1978 av Daniel Nathans, Arber Werner og Hamilton Smith, som mottok Nobelprisen i medisin for deres oppdagelse. Hans navn stammer generelt fra organismen der de først blir observert.
Slike enzymer er mye brukt i utviklingen av DNA -kloningsmetoder og andre molekylærbiologiske og gentekniske strategier. Karakteristikkene for gjenkjennelse av spesifikke sekvenser og kuttekapasitet av sekvensene nær gjenkjennelsesstedene gjør dem til kraftige verktøy i genetisk eksperimentering.
Fragmentene generert av restriksjonsenzymer som har vist seg på et bestemt DNA -molekyl, kan brukes til å gjenskape et "kart" over det originale molekylet ved å bruke informasjon på stedene der enzymet kuttet DNA.
Noen begrensningsenzymer kan ha samme gjenkjennelsessted i DNA, men de kutter det ikke nødvendigvis på samme måte. Dermed er det enzymer som gjør kutt som etterlater romos og enzymer som kutter etterlater sammenhengende ytterpunkter, som har forskjellige anvendelser innen molekylærbiologi.
Det er for tiden hundrevis av forskjellige begrensningsenzymer kommersielt tilgjengelige, som tilbys av forskjellige kommersielle hus; Disse enzymene fungerer som "skreddersydd" molekylær saks for forskjellige formål.
[TOC]
Funksjoner
Begrensningsenzymer oppfyller den motsatte funksjonen til polymeraser, siden de er hydrolysert eller bryter esterbindingen i fosfodisterbindingen mellom tilstøtende nukleotider i en nukleotidkjede.
I molekylærbiologi og genteknologi er de mye brukte verktøy for konstruksjon av ekspresjons- og kloningsvektorer, samt for identifisering av spesifikke sekvenser. De er også nyttige for konstruksjon av rekombinante genomer og har stort bioteknologisk potensial.
Nyere fremskritt innen genterapi benytter seg av restriksjonsenzymer for innføring av gener som er bestemt i vektorer som er kjøretøy for transport av slike gener til levende celler, og at de sannsynligvis har evnen til å sette seg inn i cellegenomet for å utføre permanente endringer.
Virkningsmekanismen
Begrensningsenzymer kan katalysere DNA -kuttet dobbeltbånd, selv om noen er i stand til å gjenkjenne DNA -sekvenser og til og med RNA med enkle bånd og til og med RNA. Kuttet oppstår etter gjenkjennelse av sekvensene.
Kan tjene deg: Glioxylatsyklus: Kjennetegn, reaksjoner, regulering, funksjonerHandlingsmekanismen består av hydrolysen av fosfodisterkoblingen mellom en fosfatgruppe og en deoksyribose i skjelettet til hvert DNA av DNA. Mange av enzymene er i stand til å kutte på samme sted de kjenner igjen, mens andre kutter mellom 5 og 9 basepar før eller etter det samme.
Normalt kuttet disse enzymene ved 5 'enden av fosfatgruppen, noe.
Siden proteiner ikke kommer i direkte kontakt med DNA -gjenkjennelsesstedet, må disse translokerte påfølgende tider før det spesifikke stedet er oppnådd, kanskje gjennom "glidende" mekanismer på DNA -strengen.
Under det enzymatiske snittet er fosfodisterkoblingen til hver av DNA -strengene plassert innenfor et av de aktive stedene for restriksjonsenzymer. Når enzymet forlater gjenkjennelses- og skjærestedet, gjør det det gjennom ikke -spesifikke forbigående assosiasjoner.
Folkens
For øyeblikket er fem typer restriksjonsenzymer kjent. Deretter en kort beskrivelse av hver enkelt:
Type I -begrensningsenzymer
Disse enzymene er store pentameriske proteiner med tre underenheter, en av restriksjonen, en metylering og en annen for gjenkjennelse av DNA -sekvenser. Disse endonukleasene er multifunksjonelle proteiner som er i stand til å katalysere begrensning og modifikasjonsreaksjoner, har ATPASA og også DNA -topoisomera -aktivitet.
Enzymene av denne typen var de første endonukleasene som ble oppdaget, de ble renset for første gang på 1960 -tallet, og siden har de blitt studert med stor dybde.
Enzymer av type I er ikke mye brukt som et bioteknologisk verktøy, siden skjærestedet kan være i en variabel avstand på opptil 1.000 basepar angående gjenkjennelsesstedet, noe som gjør dem upålitelige når det gjelder eksperimentell reproduserbarhet.
Type II Begrensningsenzymer
De er enzymer sammensatt av homodimerer eller tetrammer som kutter DNA i steder definert mellom 4 og 8 bp lengde. Disse skjærestedene er vanligvis palindromiske, det vil si at de gjenkjenner sekvenser som leses på samme måte i begge retninger.
Mange av type II -begrensningsenzymer i bakterier kutter DNA når de anerkjenner sin utenlandske karakter, siden det ikke har de typiske modifikasjonene som det eget DNA skal ha.
Dette er enklere restriksjonsenzymer siden de ikke krever andre kofaktor enn magnesium (Mg+) for å gjenkjenne og kutte DNA -sekvensene.
Presisjonen av type II -begrensningsenzymer i gjenkjennelse og kutting av enkle sekvenser i DNA i presise posisjoner gjør dem til en av de mest brukte og uunnværlige i de fleste grener av molekylærbiologi.
Kan tjene deg: gjensidighet: egenskaper, typer, eksemplerInnenfor gruppen av type II er begrensningsenzymer flere underklasser klassifisert i henhold til visse egenskaper som er unike for hver. Klassifiseringen av disse enzymene utføres ved å legge til bokstaver i alfabetet, fra A til Z etter navnet på enzymet.
Noen av de mest kjente underklassene for deres nytte er:
Underklasse IIA
De er forskjellige underenhet Dímeros. De gjenkjenner asymmetriske sekvenser og brukes som ideelle forløpere for generering av skjære enzymer.
Underklasse IIB
De er sammensatt av en dimer til og kuttet DNA på begge sider av gjenkjennelsessekvensen. De kutter begge DNA -tråder i et baseparintervall senere fra gjenkjennelsesstedet.
IIC underklasse
Enzymer av denne typen er polypeptider med inndelings- og modifikasjonsfunksjoner av DNA -tråder. Disse enzymene kutter begge tråder asymmetrisk.
Underklasse IIE
Enzymene i denne underklassen er mest brukt i genteknologi. De har et katalytisk sted og krever generelt en alestroffektor. Disse enzymene må samhandle med to kopier av deres anerkjennelsessekvens for å gjøre en effektiv skjæring. Innenfor denne underklassen er EcoRII- og Ecori -enzymer.
Type III -begrensningsenzymer
Type III -begrensning Endonukleaser er bare sammensatt av to underenheter, den ene er ansvarlig for gjenkjennelse og modifisering av DNA, mens den andre er ansvarlig for kuttet av sekvensen.
Disse enzymene krever to kofaktorer for deres drift: ATP og magnesium. Begrensningsenzymer av denne typen har to asymmetriske gjenkjennelsessteder, translokerer DNA på en ATP -avhengig måte og kutter det mellom 20 til 30 bp ved siden av gjenkjennelsesstedet.
Type IV -begrensningsenzymer
Enzymer av type IV er enkle å identifisere siden de kuttet DNA med metyleringsmerker, de består av flere forskjellige underenheter som er ansvarlige for å gjenkjenne og kutte DNA -sekvensen. Disse enzymene bruker GTP -kofaktorer og divalente magnesium.
Spesifikke skjæresteder inkluderer nukleotidkjeder med metylert eller hydroksymetiske cytosinrester i en eller begge tråder av nukleinsyrer.
Type V Begrensningsenzymer
Denne klassifiseringsgruppen Crisper-CAS-type enzymer, som identifiserer og kutter spesifikke DNA-sekvenser av invaderende organismer. CAS -enzymer bruker en RNA -streng syntetisert guide for skarpere for å gjenkjenne og angripe invaderende organismer.
Enzymer klassifisert som type V er polypeptider strukturert av type I, II og II enzymer. De kan kutte DNA -seksjoner av nesten enhver organisme og med et stort lengdeområde. Det.
Kan tjene deg: PropionibacteriumEksempler
Begrensningsenzymer har blitt brukt for påvisning av DNA -polymorfismer, spesielt i populasjonsgenetikkstudier og evolusjonsstudier ved bruk av mitokondriell DNA, for å få informasjon om nukleotidsubstitusjonshastigheter.
For tiden har vektorene som brukes til transformasjon av bakterier med forskjellige formål multiklonasje steder der gjenkjennelsessteder for flere begrensningsenzymer er funnet.
Blant disse enzymene er de mest populære Ecori, II, III, IV og V, oppnådd og beskrevet for første gang fra OG. coli; Hindiii, fra H. Influenzae og Bamhi av B. Amyloliquefaciens.
Referanser
- Bikle, t. TIL., & Kruger, D. H. (1993). Biologi for DNA -begrensning. Mikrobiologiske anmeldelser, 57(2), 434-450.
- Boyaval, p., Moineau, s., Romero, d. TIL., & Horvath, P. (2007). CRISPR gir frifikt oppgang mot virus i prokaryoter. Vitenskap, 315(Mars), 1709-1713.
- Goodsell, d. (2002). Det molekylære perspektivet: begrensning endonukleaser. Stamceller grunnleggende i kreftmedisin, tjue, 190-191.
- Halford, s. OG. (2001). Hopping, hopping og looping av restriksjonsenzymer. Biokjemiske samfunnstransaksjoner, 29, 363-373.
- Jeltsch, a. (2003). Opprettholdelse av artsidentitet og kontrollerende spesifikasjon av bakterier: en ny funksjon for begrensning/modifikasjonssystemer? Gen, 317, 13-16.
- Krebs, J., Goldstein, e., & Kilpatrick, S. (2018). Lewins gener XII (12 Ed.). Burlington, Massachusetts: Jones & Bartlett Learning.
- Li, og., Brød, s., Zhang, og., Ren, m., Feng, m., Peng, n.,... hun, q. (2015). Utnytte type I og Type III CRISPR-CAS-systemer for redigering av genom. Nukleinsyrforskning, 1-12.
- Loenen, w. TIL. M., Dryden, d. T. F., Raleight, e. TIL., & Wilson, G. G. (2013). Type I -begrensningsenzymer og deres pårørende. Nukleinsyrforskning, 1-25.
- Nathans, d., & Smith, h. ENTEN. (1975). Begrensning Endonukleaser i analysen og omstruktureringen av DNA -molekyler. Annu. Rev. Biochem., 273-293.
- Nei, m., & Tajima, f. (1981). DNA -polymorfisme påviselig ved begrensning endonukleaser. Genetikk, 145-163.
- Pingoud, a., Fuxreiter, m., Pingoud, v., & Wende, w. (2005). Cellulære og molekylære livsvitenskap Type II Begrensning Endonukleaser: Struktur og mekanisme. CMLS Cellular and Molecular Life Sciences, 62, 685-707.
- Roberts, r. (2005). Hvordan restriksjonsenzymer ble arbeidshestene for molekylærbiologi. PNAs, 102(17), 5905-5908.
- Roberts, r. J., & Murray, K. (1976). Begrensning endonukleaser. Kritiske anmeldelser i biokjemi, (November), 123-164.
- Stoddard, f. L. (2005). Homing endonuklease struktur og funksjon. Kvartalsvise anmeldelser av biofysikk, 1-47.
- Tock, m. R., & Dryden, D. T. F. (2005). Biologien for restriksjon og anti-begrensning. Nåværende mening i mikrobiologi, 8, 466-472. https: // doi.org/10.1016/j.Min b.2005.06.003
- Wilson, g. G., & Murray, n. OG. (1991). Begrensnings- og modifiseringssystemer. Annu. Rev. Genet., 25, 585-627.
- Wu, z., & Mou, k. (2016). Genomisk innsikt i Campylobacter jejuni virulens og populasjonsgenetikk. Infec. Dis. OVERSIKT. Med., 2(3), 109-19.
- Yuan, r. (1981). Struktur og mekanisme for multifunksjonell begrensning endonukleaser. Annu. Rev. Biochem., femti, 285-315.
- « Generering av 1914 Kjennetegn, forfattere og verk
- Gjensidig utelukkende hendelsesegenskaper og eksempler »

