Aluminium Phosphuro (AIP) struktur, egenskaper, bruksområder, risikoer

- 3777
- 1039
- Prof. Joakim Johansen
Han aluminiumfosfid Det er en uorganisk forbindelse dannet av et aluminiumatom (Al) og et fosforatom (P). Dens kjemiske formel ALP. Det er et mørk grått fast stoff, eller hvis det er veldig rent, gult. Det er en ekstremt giftig forbindelse for levende vesener.
Aluminiumfosfuro reagerer med fuktighet for å danne fosfin eller fosfano pH3, som er en giftig gass. Av denne grunn skal ALP ikke kontakte vann. Reagerer sterkt med alkaliske syrer og løsninger.
 Aluminiumfosfid. همان [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Kilde: Wikimedia Commons.
Aluminiumfosfid. همان [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Kilde: Wikimedia Commons. Det ble brukt i fortiden til å eliminere skadedyr som insekter og gnagere på steder der kornkorn og andre landbruksprodukter ble lagret. På grunn av sin høye fare har det imidlertid vært forbudt i de fleste land i verden.
Foreløpig blir nytten i elektronikkområdet teoretisk undersøkt gjennom datamaskiner som beregner muligheten for å oppnå halvleder ALP -nanorør, det vil si ekstremt små rør som bare kan overføre elektrisitet under visse forhold.
Aluminium Phosphuro er en veldig farlig forbindelse, den må manipuleres med sikkerhetsredskaper som hansker, linser, pusteutstyr og verneklær.
[TOC]
Struktur
Alp aluminiumfosfuro dannes ved forening av et aluminiumatom ved fosfor P -atom P. Koblingen mellom de to er kovalent og trippel, derfor er den veldig sterk.
Aluminium i ALP har en oksidasjonstilstand på +3 og fosforen har en valens på -3.
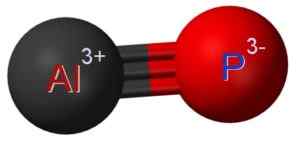 Aluminium Fosfurostruktur hvor du kan se trippelkoblingen mellom aluminium (AL) og fosfor (P) atomer (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Aluminium Fosfurostruktur hvor du kan se trippelkoblingen mellom aluminium (AL) og fosfor (P) atomer (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Nomenklatur
- Aluminiumfosfid
Egenskaper
Fysisk tilstand
Mørkegrå krystallinsk fast eller mørk gul. Kubikkkrystaller.
Molekylær vekt
57.9553 g/mol
Smeltepunkt
2550 ºC
Tetthet
2,40 g/cm3 ved 25 ° C
Løselighet
Den dekomponerer i vann.
Kjemiske egenskaper
Reagerer med fuktighet for å gi fosfin eller fosfano pH3 som er en brennbar og giftig forbindelse. Fosfin eller fosfaan.
Kan tjene deg: Gadolinio: Struktur, egenskaper, innhenting, brukAluminiumfosfuro -reaksjonen med vann er som følger:
Aluminiumfosfuro + vann → Aluminiumhydroksyd + fosfin
ALP + 3 H2O → til (å)3 + Ph3↑
Kommersielle presentasjoner har aluminiumkarbonat til2(Co3)3 For å forhindre selvretning av fosfin som oppstår når ALP kommer i kontakt med fuktigheten i luften.
ALP er stabil når den er tørr. Reagerer voldsomt med alkaliske syrer og løsninger.
Alp aluminiumfosfuro smelter ikke, og heller ikke sublimal eller dekomponerer termisk ved temperaturer så høye som 1000 ° C. Selv ved denne temperaturen er damptrykket veldig lavt, det vil si at den ikke fordamper ved den temperaturen.
Når han er oppvarmet til nedbrytningen hans avgir giftige fosforoksider. I kontakt med metaller kan du avgi brennbare hydrogengasser h2.
Andre egenskaper
Når den er ren viser den en gulaktig farging, når den er blandet med rester av preparatreaksjonen, presenterer farge fra grå til svart.
Den lave volatiliteten utelukker at den har en lukt, så lukten av hvitløk som noen ganger avgir skyldes fosfin -pH3 som dannes i nærvær av fuktighet.
Å skaffe
Aluminiumfosfuroen kan oppnås ved å varme opp en blanding av aluminium (Al) metallpulver og det røde fosforelementet (P).
På grunn av fosfor (P) ved oksygen (eller2) og det av aluminium (Al) med oksygen og nitrogen (n2), Må reaksjonen utføres i fri atmosfære av disse gassene, for eksempel hydrogenatmosfære (h2) eller naturgass.
Reaksjonen begynner raskt å varme opp et område av blandingen til reaksjonen begynner, noe som er eksotermisk (varme oppstår under det samme). Fra det øyeblikket fortsetter reaksjonen raskt.
Aluminium + fosfor → Aluminium Fosfuro
4 til + P4 → 4 ALP
applikasjoner
I eliminering av skadedyr (avviklet bruk)
Aluminium Phosphuro ble brukt i fortiden som et insektmiddel og som gnagerutrydder. Selv om det har vært forbudt av dens toksisitet, brukes den imidlertid fremdeles i noen deler av verden.
Kan tjene deg: .Stearinsyre (CH3 (CH2) 16COOH): Struktur, egenskaper, brukDet brukes til fumigation i lukkede områder der bearbeidet eller uprosesserte matprodukter finnes (for eksempel korn), mat for dyr og ikke -matprodukter.
Målet er å kontrollere insekter og gnagere som angriper lagrede artikler, enten de er spiselige eller ikke.
Det tillater kontrollerende gnagere og insekter i ikke -domestiske, landbruksmessige eller ikke -landbruksområder, fumigating Outdoors eller i hulene og reirene for å forhindre at visse sykdommer.
 Rotter og mus er skadedyr som angriper lagringssteder. For noen år siden ble de utkjempet med aluminiumfosfuro. Forfatter: Andreas n. Kilde: Pixabay.
Rotter og mus er skadedyr som angriper lagringssteder. For noen år siden ble de utkjempet med aluminiumfosfuro. Forfatter: Andreas n. Kilde: Pixabay.  Gnagere ble kontrollert ved å plassere aluminiumfosfuro i gravene sine. Forfatter: Photo-Rabe. Kilde: Pixabay.
Gnagere ble kontrollert ved å plassere aluminiumfosfuro i gravene sine. Forfatter: Photo-Rabe. Kilde: Pixabay. Brukens form består i eksponeringen av ALP i luft eller fuktighet, ettersom fosfin eller fosfaan -pH frigjøres3 som genererer skader på mange pestorganer for å eliminere.
 Insekter ble også eliminert med ALP aluminiumfosfuro. Forfatter: Michael Power. Kilde: Unspash.
Insekter ble også eliminert med ALP aluminiumfosfuro. Forfatter: Michael Power. Kilde: Unspash. I andre applikasjoner
ALP aluminiumfosfuro brukes som en kilde til fosfin eller fosfano pH3 og brukes i halvlederforskning.
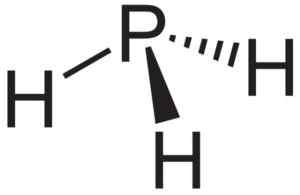 Fosfaano eller fosfin -pH3, Forbindelse som dannes når ALP aluminiumfosfuro kommer i kontakt med vann. Neuroteker [Public Domain]. Kilde: Wikimedia Commons.
Fosfaano eller fosfin -pH3, Forbindelse som dannes når ALP aluminiumfosfuro kommer i kontakt med vann. Neuroteker [Public Domain]. Kilde: Wikimedia Commons. Teoretisk forskning av ALP -nanorør
Teoretiske studier er blitt utført på dannelsen av Alp aluminium fosfuro -nanorør. Nanorør er veldig små og veldig tynne sylindere som bare kan være synlige med et elektronisk mikroskop.
ALP nanorør med bor
Teoretiske studier utført gjennom beregningsberegninger viser at urenhetene som kan legges til nanorørene til ALP, kan endre de teoretiske egenskapene til disse.
For eksempel anslås det at å legge boratomer (b) til ALP -nanorør kan gjøre dem til type halvledere-p. En halvleder er et materiale som oppfører seg som en elektrisitetsleder eller som en isolasjon avhengig av det elektriske feltet som det blir utsatt for.
Kan tjene deg: Plasmatilstand: Kjennetegn, typer og eksemplerOg en type halvleder-p Det er når materialet tilsettes urenheter, i dette tilfellet er ALP startmaterialet og boratomene vil være urenheter. Halvledere er nyttige for elektronikkapplikasjoner.
ALP nanorør med endret struktur
Noen forskere har utført beregninger for å bestemme effekten av å endre strukturen i det krystallinske nettverket til nanorørene til ALP fra sekskantet til oktaedral.
De fant at manipulasjonen av den krystallinske nettverksstrukturen kunne brukes til å justere konduktiviteten og reaktiviteten til ALP -nanorør og designe dem slik at de er nyttige for elektronikk og optiske applikasjoner.
Risiko
Kontakt med aluminiumfosfuro kan irritere huden, øynene og slimhinnene. Hvis den blir inntatt eller inhalert, er den giftig. Det kan tas opp gjennom huden med giftige effekter.
Hvis ALP kommer i kontakt med vann reagerer og fosfinform eller fosfan -pH3 som er ekstremt brannfarlig fordi det brenner i kontakt med luften. Derfor kan det utnytte. I tillegg forårsaker fosfin mennesker og dyr død.
Siden et økonomisk plantevernmiddel er aluminiumfosfuro, er bruken en vanlig årsak til folks forgiftning og innebærer en høy dødelighetsrate.
 Aluminium Phosphuro er ekstremt farlig. Forfatter: OpenClipart-vektorer. Kilde: Pixabay.
Aluminium Phosphuro er ekstremt farlig. Forfatter: OpenClipart-vektorer. Kilde: Pixabay. Reagerer med fuktigheten av slimhinnene og med HCl -saltsyre i magen som danner den veldig giftige fosfan -pH -gassen3. Derfor, ved innånding og inntak, dannes fosfin i kroppen, med dødelige effekter.
Inntaket forårsaker blødning av mage -tarmkanalen, kardiovaskulær kollaps, nevropsykiatriske lidelser, luftveis- og nyresvikt på noen få timer.
ALP er veldig giftig for alle terrestriske og vannlevende dyr.
Referanser
- ELLER.S. National Library of Medicine. (2019). Fosfidaluminium. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Sjögren, f. et al. (2007). Aluminium. Andre aluminiumforbindelser. I håndbok om toksikologien til metaller (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Gupta, r.C. og Crissman, J.W. (2013). Sikkerhetsvurdering inkludert aktuelle og nye problemer i toksikologipatologi. Menneskelig risiko. I Haschek og Rousseaux's Handbook of Toxicology Pathology (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Hvit, w.OG. og Bushey, til.H. (1944). Aluminiumfhosfid - Forberedelse og sammensetning. Journal of the American Chemical Society 1944, 66, 10, 1666-1672. Gjenopprettet fra puber.ACS.org.
- Mirzaei, Maryam og Mirzaei, Mahmoud. (2011). En teoretisk studie av bor-due aluminiumfosfid-nanorør. Computational and Theoretical Chemistry 963 (2011) 294-297. Gjenopprettet fra Scientedirect.com.
- Takahashi, l. Og Takahashi, k. (2018). Tuning av den elektroniske strukturen til et aluminiumfosfid nanorør dette. ACS Appl. Nano Mater. 2018, 1, 501-504. Gjenopprettet fra puber.ACS.org.
- Gupta, p.K. (2016). Giftige effekter av pesicider (agrokjemikalier). Fosfidaluminium. I fond for toksikologi. Gjenopprettet fra Scientedirect.com.
- « Rektangulære koordinater eksempler og øvelser løst
- Grad av et polynom hvordan det bestemmes, eksempler og øvelser »

