Kvikksølvhydroksydstruktur, egenskaper, bruksområder
- 1661
- 326
- Mathias Aas
Han Kvikksølvhydroksyd Det er en uorganisk forbindelse der kvikksølvmetallet (HG) har et oksidasjonsnummer på 2+. Den kjemiske formelen er HG (OH)2. Imidlertid er denne arten ennå ikke oppnådd i fast form under normale forhold.
Kvikksølv eller Mercuric Hydroxide Hydroxide er en forbigående kort levetid i dannelsen av HGO Mercuric Oxide i alkalisk løsning. For studier utført i HGO Mercuric Oxide Solutions, har det blitt trukket ut at HG (OH)2 Det er en svak base. Andre arter som følger med det er hgoh+ og HG2+.
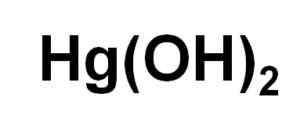 Kjemisk formel for kvikksølvhydroksyd (II). Forfatter: Marilú Stea.
Kjemisk formel for kvikksølvhydroksyd (II). Forfatter: Marilú Stea. Til tross for at han ikke kunne bli utfelt i vandig løsning, HG (OH)2 Det er oppnådd ved fotokjemisk reaksjon av kvikksølv med hydrogen og oksygen ved veldig lave temperaturer. Det er også oppnådd i form av en koppipitert sammen med troen (OH)3, der tilstedeværelsen av haluro -ioner utøver innflytelse på pH -pH der koprekking skjer.
Siden det ikke lett har oppnådd rent på laboratorietivå, har det ikke vært mulig å finne noe verktøy for denne forbindelsen, eller bestemme risikoen for bruken. Imidlertid kan det trekkes ut at det gir samme risiko som de andre kvikksølvforbindelsene.
[TOC]
Molecula Structure
Strukturen til kvikksølvhydroksyd (ii) Hg (OH)2 Det er basert på en lineær sentral del dannet av kvikksølvatomet med de to oksygenatomene til sidene.
Hydrogenatomene er forent til denne sentrale strukturen, hver ved siden av hvert oksygen, som dreier seg fritt rundt hvert oksygen. Det kan være representert på en enkel måte som indikert nedenfor:
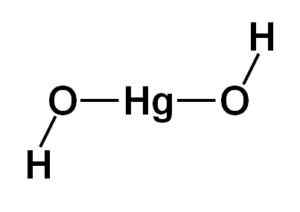 Teoretisk struktur av kvikksølvhydroksid (II). Forfatter: Marilú Stea
Teoretisk struktur av kvikksølvhydroksid (II). Forfatter: Marilú Stea Elektronisk konfigurasjon
Den elektroniske strukturen til den metalliske kvikksølv HG er som følger:
[Xe] 5d10 6s2
hvor [xe] er den elektroniske konfigurasjonen av edelgass xenon.
Når du observerer denne elektroniske strukturen, er det avledet at den mest stabile oksidasjonstilstanden til kvikksølv er den der de 2 elektronene i lag 6 går tapts.
I Hg (OH) Mercuric hydroxide2, Kvikksølvatom (Hg) finnes i sin oksidasjonstilstand 2+. Derfor i HG (OH)2 Kvikksølv har følgende elektroniske konfigurasjon:
Det kan tjene deg: 30 bruk av karboksylsyrer i hverdagen[Xe] 5d10
Nomenklatur
- Kvikksølvhydroksyd (II)
- Mercuric hydroksyd
- Kvikksølvdihydroksyd
Egenskaper
Molekylær vekt
236,62 g/mol
Kjemiske egenskaper
I følge informasjonen som er konsultert, er det mulig at HG (OH)2 Være en forbigående forbindelse i dannelsen av HGO i alkalisk vandig medium.
Tilsetning av hydroksylioner (OH-) til en vandig løsning med Mercuric -ioner HG2+ Det fører til nedbør av et gult fast kvikksølvoksid (II) HGO, hvorav Hg (OH)2 Det er en passasjer eller midlertidig agent.
 Kvikksølvoksid (II). Leiem [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikipedia Commons.
Kvikksølvoksid (II). Leiem [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikipedia Commons. I vandig løsning HG (OH)2 Det er en veldig kort levetid, fordi det raskt frigjør et vannmolekyl og utlever det faste HGO.
Selv om det ikke har vært mulig å utfelle den kvikkske hydroksyd HG (OH)2, Kvikksølvoksid (II) HGO er noe løselig i vann som danner en løsning av arter som kalles "hydroksider".
Disse artene i vann som kalles "hydroksider" er svake baser, og selv om de noen ganger oppfører seg som amfotorater, generelt HG (OH)2 Det er mer grunnleggende enn syre.
Når HGO oppløses i HCLO4 Studier indikerer tilstedeværelsen av kvikksøking Hg2+, En Hgoh monohydroximercuro -ion+ og Hg (OH) Mercuric hydroxide2.
Saldoene som oppstår i slike vandige oppløsninger er følgende:
Hg2+ + H2Eller ⇔ HgoH+ + H+
Hgoh+ + H2Eller ⇔ Hg (OH)2 + H+
I NaOH er alkaliske løsninger arten Hg (OH) dannes3-.
Å skaffe
Ren kvikksølvhydroksyd
Kvikksølvhydroksyd (ii) Hg (OH)2 Det kan ikke oppnås i vandig løsning, fordi ved å tilsette alkali til en løsning av HG -handelsioner2+, Utgifter det gule kvikksyden.
Noen forskere klarte imidlertid å skaffe seg i 2005 for første gang HG (OH) Mercuric Hydroxide2 ved hjelp av en kvikksølvbue -lampe, med utgangspunkt i kvikksølv HG -elementet, hydrogen H2 og oksygen eller2.
 Kvikksølvlampe. D-Kuru [CC By-SA 2.0 AT (https: // creativecommons.Org/lisenser/by-SA/2.0/at/gjerning.i)]. Kilde: Wikipedia Commons.
Kvikksølvlampe. D-Kuru [CC By-SA 2.0 AT (https: // creativecommons.Org/lisenser/by-SA/2.0/at/gjerning.i)]. Kilde: Wikipedia Commons. Reaksjonen er fotokjemisk og ble utført i nærvær av neon, argon eller fast deuterium ved veldig lave temperaturer (ca. 5 k = 5 grader kelvin). Bevisene for sammensatt formasjon ble oppnådd ved IR -lysabsorpsjonsspektre (infrarød).
Kan tjene deg: bunnfallHG (OH)2 Utarbeidet på denne måten er veldig stabil under erfaringsbetingelsene. Det anslås at den fotokjemiske reaksjonen fortsetter gjennom O-Hg-O-mellomleddet til det stabile molekylet H-O-Hg-O-H.
CopRecipitation med jernhydroksid (III)
Hvis kvikksølvsulfat (ii) oppløses HGSO4 og jernsulfat (iii) tro2(SW4)3 I syre vandig oppløsning, og pH begynner å bli økt ved å tilsette en NaOH -natriumhydroksydoppløsning, er det etter en hviletid som blir utledet dannet, en koprekkitt Hg (OH)2 og tro (å)3.
Det har blitt funnet at dannelsen av HG (OH)2 Det er et kritisk skritt i denne kopieringen med tro (OH)3.
Dannelsen av HG (OH)2 I bunnfallet (OH)3-HG (OH)2 Det avhenger sterkt av tilstedeværelsen av ioner som fluor, klorid eller bromid, av den spesifikke konsentrasjonen av disse og pH i løsningen.
I nærvær av fluor (f-), En pH større enn 5, kopiering av Hg (OH)2 Med tro (å)3 påvirkes ikke. Men til en pH på 4 dannelse av komplekser mellom Hg2+ og f- interfererer i kopiering av HG (OH)2.
I tilfelle av tilstedeværelsen av klorid (CL-), Koprekking av HG (OH)2 Det forekommer en pH på 7 eller høyere, det vil si helst i alkalisk medium.
Når bromidet er til stede (BR-), Koprekking av HG (OH)2 Det vises ved enda større pH, det vil si pH over 8,5 eller mer alkalisk enn med klorid.
applikasjoner
Fra gjennomgangen av tilgjengelige informasjonskilder følger det at kvikksølvhydroksid (ii) Hg (OH)2, Å være en forbindelse som ennå ikke er forberedt kommersielt, har det ingen kjente bruksområder.
Nylige studier
Gjennom beregningssimuleringsteknikker i 2013 ble de strukturelle og energiegenskapene relatert til HG (OH) hydrering studert2 I en gassformig tilstand.
Metall-ligando koordinering og solvasjonsenergier ble beregnet og sammenlignet ved å variere graden av Hg (OH) hydrering2.
Blant annet ble det funnet at tilsynelatende den teoretiske oksidasjonstilstanden er 1+ i stedet for den påståtte 2+ som vanligvis er tildelt HG (OH)2.
Kan tjene deg: teoretisk ytelseRisiko
Selv om HG (OH)2 Som sådan ikke er isolert i tilstrekkelig kvantitet.
Det kan være giftig for nervesystemet, fordøyelsessystemet, huden, øynene, luftveiene og nyrene.
Innånding, inntak eller kontakt med huden til kvikksølvforbindelser kan forårsake skade som spenner fra irritasjon av øyne og hud, søvnløshet, hodepine, skjelvinger, skade på tarmsystemet, hukommelsestap, til nyreinsuffisiens, mellom andre symptomer.
Kvikksølv har blitt anerkjent internasjonalt som en forurensning. De fleste av kvikksølvforbindelsene som kommer i kontakt med miljøet er metylert av bakteriene som er til stede i jord og sedimenter, og danner metylkvikksølv.
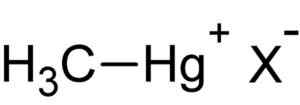 Metylkvikksølv hal. Forfatter: Lastet opp av bruker: Rifleman 82. Kilde: Ukjent. Kilde: Wikipedia Commons.
Metylkvikksølv hal. Forfatter: Lastet opp av bruker: Rifleman 82. Kilde: Ukjent. Kilde: Wikipedia Commons. Denne forbindelsen er bioaccumula i levende organismer, som går fra bakken til plantene og derfra til dyrene. I vannmiljøet er overføringen enda raskere, og passerer fra veldig små arter til det store på kort tid.
Metylkvikksølv har en giftig effekt for levende vesener og spesielt for menneske, som inntar den gjennom næringskjeden.
Når du inntatt med mat er spesielt skadelig for små barn og fostre hos gravide, siden det å være et nevrotoksin kan forårsake hjerneskade og nervesystem i dannelse og vekst.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Wang, Xuefeng og Andrews, Lester (2005). Infrarød spekter av HG (OH)2 i solid neon og argon. Uorganisk kjemi, 2005, 44, 108-113. Gjenopprettet fra puber.ACS.org.
- Amaro-Estrada, J.Yo., et al. (2013). Vandig solvasjon av HG (OH)2: Energisk og dynamisk tetthet Funksjonsteori Studier av HG (OH)2-(H2ENTEN)n (N = 1-24) Strukturer. J. Phys. Chem. Til 2013, 117, 9069-9075. Gjenopprettet fra puber.ACS.org.
- Inoue, Yoshikazu og Munemori, Makoto. (1979). CopRecipitation of Mercury (II) med jern (III) hydroksyd. Miljøvitenskap og teknologi. Volum 13, nummer 4, april 1979. Gjenopprettet fra puber.ACS.org.
- Chang, l.W., et al. (2010). Nervesystem og atferdstoksikologi. I forståelse av toksikologi. Gjenopprettet fra Scientedirect.com.
- Haney, Alan og Lipsey, Richard L. (1973). Akkumulering og effekter av metylkvikksølvhydroksyd i en terrestrariell næringskjede under laboratorieinnhold. Miljø. Forurensning. (5) (1973) PP. 305-316. Gjenopprettet fra Scientedirect.com.
- « Flavin adenin dinukleotid (FAD) egenskaper, biosyntese
- Glyceraldehyd 3-fosfat (G3P) struktur, funksjoner »

