Atomisk massedefinisjon, typer, hvordan du beregner det, eksempler
- 819
- 56
- Theodor Anders Hopland
De Atommasse Det er mengden materie som er til stede i et atom, som kan uttrykkes i vanlige fysiske enheter eller i atommasseenheter (UMA eller U). Et atom er tomt i nesten hele strukturen; Elektroner som er uskarpe i regioner som kalles orbital, der det er en viss sannsynlighet for å finne dem, og kjernen deres.
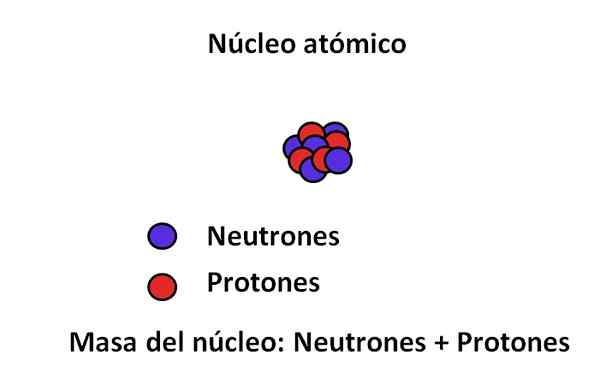
I atomets kjerne er protoner og nøytroner; Den første med positive ladninger, mens sekundene med nøytral belastning. Disse to subatomiske partiklene har en mye større masse enn elektronet; Derfor styres massen av et atom av kjernen og ikke av tomrommet eller elektronene.
 De viktigste subatomiske partiklene og kjernenes masser. Kilde: Gabriel Bolívar.
De viktigste subatomiske partiklene og kjernenes masser. Kilde: Gabriel Bolívar. Massen til et elektron er omtrent 9,1 · 10-31 kg, mens proton 1,67 · 10-27 kg, å være masseforholdet på 1.800; det vil si en proton "veier" 1.800 ganger mer enn et elektron. Tilsvarende skjer det samme med massene av nøytron og elektron. Det er grunnen til at massebidraget til elektronet for ordinære formål anses som ubetydelig.
På grunn av dette antas det vanligvis at massen av atomet, eller atommasse bare avhenger av massen til kjernen; som igjen består av summen av emnet nøytroner og protoner. Fra dette resonnementet dukker det opp to konsepter: massenummer og atommasse, begge intimt beslektede.
Å ha så mye "tom" i atomer, og siden massen nesten er kjernen, forventes det at sistnevnte vil være ekstra tette.
Hvis vi tok dette tomrommet til et hvilket som helst kropp eller objekt, ville dimensjonene være drastisk. Hvis vi kunne bygge et lite objekt basert på atomkjerner (uten elektroner), ville dette ha en masse millioner av tonn.
På den annen side hjelper atommasser med å skille forskjellige atomer fra det samme elementet; Dette er isotopene. Å ha rikere isotoper enn andre, et gjennomsnitt av atommassene for et visst element må estimeres; Gjennomsnitt som kan variere fra planeten på planeten, eller fra en romområde til en annen.
[TOC]
Definisjon og konsept

Per definisjon er atommassen summen av massene av deres protoner og nøytroner uttrykt med UMA eller U. Det resulterende tallet (også kalt massenummer) er plassert dimensjonsløst i øverste venstre hjørne i notasjonen som brukes til nukleider. For eksempel for elementet femtenX Den atommassen er 15um eller 15U.
Atommasse kan ikke si mye om den sanne identiteten til dette elementet x. I stedet brukes atomnummer, som tilsvarer protonene som huser kjernen i x. Hvis dette tallet er 7, vil forskjellen (15-7) være lik 8; Det vil si at X har 7 protoner og 8 nøytroner, hvis sum er 15.
Tilbake til bildet har kjernen 5 nøytroner og 4 protoner, så massetallet er 9; Og på sin side er 9 Uma massen av atomet. Å ha 4 protoner, og konsultere det periodiske bordet, kan det sees at denne kjernen tilsvarer berylliumelementet, være (eller 9VÆRE).
Atommasseenhet
Atomer er for små til å måle massene sine gjennom konvensjonelle metoder eller vanlige skalaer. Det er av denne grunn at UMA, eller O da (Daltón) ble oppfunnet. Disse enhetene som er utviklet for atomer lar deg ha en ide om hvor massive atomene i et element er i forhold til hverandre.
Kan tjene deg: kobolt: struktur, egenskaper, applikasjonerMen hva representerer en UMA? Det må være en referanse som lar deg etablere masseforhold. For å gjøre dette ble atomet brukt som referanse 12C, som er den mest tallrike og stabile isotopen for karbon. Å ha 6 protoner (deres atomnummer z), og 6 nøytroner, atommassen er derfor 12.
Det antas at protoner og nøytroner har de samme massene, slik at hvert bidrag 1 uma. Enheten for atommasse blir deretter definert som den tolv delen (1/12) av massen et karbon-12-atom; Dette er massen til et proton eller nøytron.
Ekvivalens i gram
Og nå oppstår følgende spørsmål: hvor mange gram tilsvarer 1 uma? Som til å begynne med var det ingen teknikker som ble avansert nok til å måle det, kjemikaliene måtte nøye seg med å uttrykke alle massene med UMA; Dette var imidlertid en fordel og ikke en ulempe.
Fordi? Fordi det å være de små subatomiske partiklene, akkurat som barn, må det være deres masse uttrykt i gram. Faktisk tilsvarer 1 UMA 1 6605 · 10-24 gram. I tillegg, med bruk av molbegrepet, var det ikke noe problem å arbeide massene av elementene og deres isotoper med UMA og visste at slike enheter kunne modifiseres til g/mol.
For eksempel tilbake til femtenX og 9Være, vi har at atommassene deres er henholdsvis 15 UMA og 9 UMA. Siden disse enhetene er så små og ikke sier hvor mye sak man må "veie" for å manipulere dem, forvandles de til sine respektive molmasser: 15 g/mol og 9 g/mol (introduserer begrepene mol og avogadro -nummer).
Gjennomsnittlig atommasse
Ikke alle atomer av samme element har samme masse. Dette betyr at de må ha mer subatomiske partikler i kjernen. Å være det samme elementet, atomnummeret eller antall protoner må forbli konstant; Derfor er det bare variasjon i mengden nøytroner som har.
Dermed ser det ut av definisjonen av isotoper: atomer av samme element, men med forskjellige atommasser. For eksempel består Beryllium nesten helt av isotopen 9Være, med spor av spor 10Være. Dette eksemplet hjelper imidlertid ikke mye med å forstå begrepet gjennomsnittlig atommasse; Vi trenger en med flere isotoper.
Eksempel
Anta at elementet eksisterer 88J, dette er den viktigste isotopen til J med en overflod på 60%. J har i tillegg to andre isotoper: 86J, med en overflod på 20%, og 90J, med en overflod også 20%. Dette betyr at fra 100 J -atomer som vi samler på jorden, er 60 av dem 88J, og de resterende 40 en blanding av 86J og 90J.
Hver av de tre isotoper av J har sin egen atommasse; det vil si summen av nøytroner og protoner. Imidlertid må disse massene i gjennomsnitt være i stand til å ha atom en atommasse for J; Her på jorden, siden det kan være andre regioner i universet der overflod av 86J er 56% og ikke 60%.
Kan tjene deg: natrium: historie, struktur, egenskaper, risikoer og brukFor å beregne den gjennomsnittlige atommassen til J, må det vektede gjennomsnittet av massene av isotoper oppnås; det vil si å ta hensyn til prosentandelen av overflod for hver av dem. Dermed har vi:
Gjennomsnittlig masse (J) = (86 UMA) (0,60) + (88 UMA) (0,20) + (90 UMA) (0,20)
= 87.2 UMA
Det vil si den gjennomsnittlige atommassen (også kjent som J er 87,2 UMA. I mellomtiden er molmassen 87,2 g/mol. Merk at 87.2 er nærmere enn 88 enn 86, og er også fjern fra 90.
Absolutt atommasse
Absolutt atommasse er atommassen uttrykt i gram. Med utgangspunkt i eksemplet med det hypotetiske elementet, kan vi beregne den absolutte atommassen (gjennomsnittet), vel vitende om at hver UMA tilsvarer 1 6605 · 10-24 gram:
Absolutt atommasse (J) = 87,2 UMA * (1 6605 · 10-24 g/ uma)
= 1.447956 · 10-22 g/atom j
Dette betyr at i gjennomsnitt J -atomer har en absolutt masse på 1.447956 · 10-22 g.
Relativ atommasse
Den relative atommassen er identisk med den gjennomsnittlige atommassen for et gitt element; I motsetning til det andre, mangler imidlertid den første enhet. Derfor er det dimensjonsløst. For eksempel er den gjennomsnittlige atommassen av beryllium 9.012182 U; Mens den relative atommassen ganske enkelt er 9.012182.
Det er grunnen til at disse konseptene vanligvis misforstår som synonymer, siden de er veldig like og forskjellene mellom dem er subtile. Men hva er disse massene relative? I forhold til den tolv delen av massen til 12C.
Dermed betyr et element med en relativ atommasse på 77 at det har en masse 77 ganger større enn 1/12 del av 12C.
De som har tjent elementene i det periodiske tabellen, kan se at massene deres kommer til uttrykk relativt. De har ikke UMA -enheter, og det tolkes som: jern har en atommasse på 55.846, noe som betyr at det er 55.846 ganger mer massiv enn massen på 1/12 del av 12C, og det kan også uttrykkes som 55.846 UMA eller 55.846 g/mol.
Hvordan beregne atommasse
Matematisk et eksempel på hvordan du beregner det med eksemplet på elementet J. Generelt sett må den vektede gjennomsnittlige formelen brukes, som vil være:
P = σ (isotop atommasse) (overflod i desimaler)
Med andre ord, å ha atommassene (nøytroner + protoner) av hver isotop (vanlig naturlig) for et visst element, så vel som deres respektive terrestriske forekomster (eller hva regionen vurderes), kan det beregnes vektet gjennomsnittlig gjennomsnitt.
Og hvorfor ikke bare det aritmetiske gjennomsnittet? For eksempel er den gjennomsnittlige atommassen til J 87,2 UMA. Hvis vi beregner denne massen igjen, men på en aritmetisk måte, vil vi ha:
Gjennomsnittlig masse (J) = (88 UMA + 86 UMA + 90 UMA)/3
= 88 UMA
Merk at det er en viktig forskjell mellom 88 og 87.2. Dette er fordi det i det aritmetiske gjennomsnittet antas at overflod av alle isotoper er den samme; Når det er tre J -isotoper, må hver ha en overflod på 100/3 (33,33%). Men det er egentlig ikke: det er mye rikelig med isotoper enn en annen.
Det kan tjene deg: uretan: struktur, egenskaper, innhenting, brukDet er grunnen til at det vektede gjennomsnittet beregnes, siden det tas i betraktning hvor rikelig er en isotop med hensyn til en annen.
Eksempler
Karbon
For å beregne den gjennomsnittlige atommassen av karbon trenger vi dens naturlige isotoper med deres respektive overflod. I tilfelle av karbon er disse: 12C (98,89%) og 1. 3C (1,11%). De relative atommassene av dem er henholdsvis 12 og 13, som igjen er lik 12 UMA og 13 UMA. Løsning:
Gjennomsnittlig atommasse (C) = (12 UMA) (0,9889) + (13 UMA) (0,0111)
= 12.0111 UMA
Derfor er massen av et karbonatom i gjennomsnitt 12,01 UMA. Har mengder spor av 14C, det har nesten ingen innflytelse på dette gjennomsnittet.
Natrium
Alle terrestriske natriumatomer består av isotopen 23Na, så dens overflod er 100%. Det er grunnen til at det i vanlige beregninger kan antas at massen ganske enkelt er 23 UMA eller 23 g/mol. Imidlertid er den eksakte massen 22.98976928 UMA.
Oksygen
De tre oksygenisotoper med sine respektive forekomster er: 16O (99,762%), 17Eller (0,038%) og 18O (0,2%). Vi har alt for å beregne den gjennomsnittlige atommassen:
Gjennomsnittlig atommasse (O) = (16 UMA) (0,99762) + (17 UMA) (0,00038) + (18 UMA) (0,002)
= 16.00438 UMA
Selv om den eksakte massen som rapporteres faktisk er 15.9994 UMA.
Nitrogen
Gjenta de samme trinnene med oksygen vi har: 14N (99.634%) og femtenN (0,366%). Så:
Gjennomsnittlig atommasse (n) = (14 UMA) (0,99634) + (15 UMA) (0,00366)
= 14.00366 UMA
Merk at massen som er rapportert for nitrogen er 14 0067 UMA, litt større enn det vi beregner.
Klor
Isotoper av klor med sine respektive forekomster er: 35CL (75,77%) og 37CL (24,23%). Beregning av den gjennomsnittlige atommassen vi har:
Gjennomsnittlig atommasse (CL) = (35 UMA) (0.7577) + (37 UMA) (0.2423)
= 35.4846 UMA
Svært lik rapporten (35.453 UMA).
Disposio
Og til slutt vil den gjennomsnittlige massen til et element med mange naturlige isotoper bli beregnet: disposio. Disse og med deres respektive forekomster er: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) og 164Dy (28,18%).
Vi fortsetter som de tidligere eksemplene for å beregne atommassen til dette metallet:
Gjennomsnittlig atommasse (DY) = (156 UMA) (0,0006%) + (158 UMA) (0,0010) + (160 UMA) (0,0234) + (161 UMA) (0,1891) + (162 UMA) (0,2551) + (163 UMA) (0.2490) + (164 UMA) (0.2818)
= 162.5691 UMA
Den rapporterte massen er 162 500 UMA. Merk at dette gjennomsnittet er mellom 162 og 163, siden isotopene 156Dy, 158Dy og 160Dy er få rikelig; mens de som dominerer er 162Dy, 163Dy og 164Dy.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2019). Atommasse. Hentet fra: i.Wikipedia.org
- Christopher Masi. (s.F.). Atommasse. Gjenopprettet fra: WSC.Masse.Edu
- Natalie Wolchover. (12. september 2017). Hvordan vekter du et atom? Live Science. Gjenopprettet fra: Livescience.com
- Kjemi librettexts. (5. juni 2019). Beregning av atommasser. Gjenopprettet fra: Chem.Librettexts.orks
- Edward Wichers og H. Steffen Peiser. (15. desember 2017). Atomvekt. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- « Elektrokonvulsive terapiegenskaper, effekter og applikasjoner
- Embryologihistorie, studieretning og grener »

