Pepsinogenstruktur, funksjoner, typer, syntese
- 1508
- 151
- Mathias Aas
Han Pepsinogen Det er zimogenet til pepsinet, en av de viktigste hydrolytiske enzymer som har ansvaret for å utføre proteinfordøyelse i pattedyrets mage. Zimogener eller proenzymer er inaktive enzymatiske forløpere, det vil si at de ikke klarer å katalysere reaksjonene som er utført av sine aktive former.
Aktiveringen avhenger av endringer i den tre -dimensjonale strukturen til proteinet som gir opphav til dannelsen av et funksjonelt aktivt sted. Disse endringene sammenfaller i de fleste tilfeller med den proteolytiske brudd på et proteinsegment.
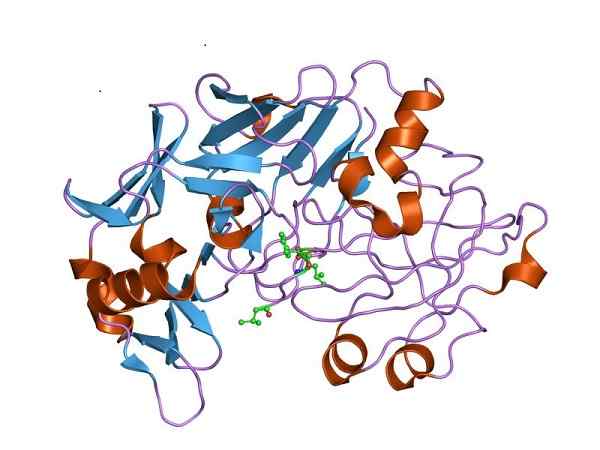
 Tre -dimensjonal struktur av pepsin, den katalytisk aktive formen av pepsinogen. Av Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain (https: // CreativeCommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons
Tre -dimensjonal struktur av pepsin, den katalytisk aktive formen av pepsinogen. Av Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain (https: // CreativeCommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons Derfor må pepsinogen oppleve strukturelle endringer for å tilegne seg den nødvendige peptidaseaktiviteten og favorisere proteinfordøyelse i magen, etter matinntak.
[TOC]
Struktur
Pepsinogen er et 371 aminosyreprotein som tilhører den store familien av aspartiske proteinaser, preget av å presentere asparaginsyrerester i det aktive senteret.
Den kvartære strukturen ble bestemt for første gang for proteinet uttrykt i griser gjennom X -Ray Crystallography -teknikken. Resultatet var likt det som ble vist ved den modne eller aktive formen av proteinet, Pepsin.
Dermed er den eneste forskjellen som er funnet, tilstedeværelsen i pepsinogenet til et 44 aminosyrepeptid som brettes over kløften til det aktive stedet. I denne posisjonen hindrer det interaksjonen mellom denne proteasen med proteiner som skal nedbrytes.
Dette peptidet som vil bli kledd for å gi opphav til det aktive enzymet, er lokalisert ved aminotallenden av proteinet.
Siden det bare fungerer som en hette, skyldes ikke manglende evne til å nedbryte proteinpepsinogenet strukturelle deformasjoner av det aktive senteret. Tvert imot, dette forblir med samme konformasjon i begge former for enzymet.
Kan tjene deg: glukaner: struktur, egenskaper og funksjonerI denne forstand er det verdt å merke seg at krystallstrukturen i pepsinogenet utgjør en omtrentlig modell av strukturen til andre zimogenos som tilhører den store familien av aspartiske proteiner.
Funksjoner
I begynnelsen av livet er pepsin (aktiv form for pepsinogen) viktig for fordøyelse av melke. Deretter er dens funksjon å nedbryte kostholdsproteiner i sine bestanddeler (aminosyrer) for å lette deres enkle absorpsjon.
Syntese og sekresjon
Pepsinogen syntetiseres av hovedcellene og fundiske celler i mageslimhinnen. Deretter lagres det i sekretoriske vesikler som forblir i cytoplasmaet til disse cellene til det øyeblikket deres frigjøring er nødvendig.
Derfor er sekresjonen av denne zimogen en prosess som er regulert. Dets frigjøring av vesikler, innbyggere i cytosol gjennom eksocytose, krever hormonell og nevrale stimuli. Økningen i nivåene av gastriske enzymer skiller ut og gastrin, samt acetylkolin, kolecystokinin, epidermal vekstfaktor og nitrogenoksid stimulerer deres syntese og sekresjon.
I tillegg har eksperimenter utført med ATT20 -celler, en cellelinje som vanligvis brukes i studiet av sekresjonsveier hos pattedyr, vist at en økning i syklisk forsterker også er i stand til å indusere slik sekresjon.
I tillegg til dens normale sekresjon på magenivå, er det blitt påvist en relativt lav mengde pepsinogen i både blod og urin, og det er derfor det har blitt kalt uropepsinogen.
Opprinnelsen til Uropepsinogen, så vel som funksjonen som den kan utføre begge stedene, gjenstår uten å bli bestemt. Deres fravær hos pasienter som totalt har fjernet magen ser ut til å indikere at opprinnelsen deres er like mage.
Folkens
To hovedtyper av pepsinogen er beskrevet så langt: Pepsinogen I og Pepsinogen II. Begge typer presenterer ikke forskjeller i sin katalytiske aktivitet og aktiveres like ved proteolytisk hydrolyse avhengig av saltsyre.
Kan tjene deg: protein denaturering: hva er faktorer, konsekvenserPepsinogen I syntetiseres og segregeres av både hovedcellene og av de fundiske cellene i mageslimhinnen. Derfor avtar sekresjonen av pasienter med atrofisk kronisk gastritt, en magesykdom preget av total forsvinning av magekjertler.
I motsetning til sistnevnte, syntetiseres Pepsinogen II (PGII) av praktisk talt alle celler som er en del av mageslimhinnen, men mer fremtredende av de av Antral Mucosa og de som utgjør Brünner -kjertlene som er til stede i Duodenum.
Hos pasienter med atrofisk kronisk gastritt kompenserer denne typen pepsinogen for reduksjon i pepsinogensekresjon I.
Eksistensen av disse to typene pepsinogen, som bare er forskjellige ved å bli utskilt av forskjellige celler, kan virke overflødig. Imidlertid kan det være en evolusjonær tilpasning for å garantere pepsinsyntese når det er nødvendig.
Aktivering
Pepsinogen tilegner seg katalytisk aktivitet når det blir transformert til pepsin, produkt av eliminering av det 44 aminosyrepeptidet som er til stede i det aktive stedshulen.
Den optimale driften avhenger av lave pH -verdier inkludert i området 1,5 til 2. Under fysiologiske forhold opprettholdes disse verdiene ved sekresjon av saltsyre i intracellulære kanaler.
Syre fordøyelse på magenivå foregår ikke hos alle dyr, og er et eksempel på dette er insekter, som mangler pepsinogen. Imidlertid virveldyr som har mage hvis de har magesaktivitet.
Pepsinogen, som lagres i sekretoriske vesikler i hovedcellene, frigjøres til magekanalen når det er nødvendig. Når den når magen, blir det pepsinprodukt av det sure miljøet og dette aktive mer pepsinogene molekyler.
Ved virkning av iboende nervefibre og vagal ekstrinsik stimulering, stimuleres pepsinogenproduksjon, så vel som HCl, gastrin og histamin. På den annen side stimulerer histamin og gastrin parietalceller til å utskille HCl.
Kan tjene deg: ledende stoffer: hva er, egenskaper, funksjonerPepsin, som alle endopeptidase, virker på spesifikke koblinger mellom proteinaminosyrer for å generere mindre peptider.
Med andre ord; Hydrolyserer de indre peptidbindinger av et protein. Virkningen er mer effektiv i peptidkoblinger nær aromatiske aminosyrer (fenylalanin, tyrosin). I motsetning til forløperen Zimogen, produserer de adaptive endringene av pepsinet i pH -verdier større enn 6 irreversible fall av katalytisk aktivitet.
Referanser
- Bryksa BC, Tanaka T, Yada Ry. N-terminal modifisering øker nøytral-pH-stabiliteten til pepsin. Biokjemi. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Sammenligning av de primære strukturene av sure protessa og deres zymogener. Adv exp med biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Lærebok for medisinsk fisiologi. (11. utg.). USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, prinsipper for indremedisin. (16. utg.). Mexico: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Alvorlig atrofisk gastritt med Helicobacter pylori -infeksjon og gastrisk kreft. Gastrisk kreft. 1998; 1: 118-124.
- Lin Y, funnet M, Lin X, Hartsuck JA, Tang J. pH-avhengighet av kinetiske parametere av pepsin, rhizopuspepsin og deres aktive site hydrogenbindinger mutanter. J Biol Chem. 1992; 267: 18413-18418.
- Mangat p. Syresekresjon og membranorganitasjon i enkelt gastrisk parietalcelle i primærkultur. Biologicelle. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Utvikling av gastrisk sekretorisk funksjon. Fetal og nyfødt fysiologi (Femte utgave). Volum 1, side 881-888.
- Schubert Ml. Gastrisk hemmelighet. Current Opin Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James MNG. Molekylære og krystallstrukturer av monoklinisk svin pepsin foredlet ved 1.8 Å oppløsning. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. Epidemiologien til lav serum pepsinogen A -nivåer og en internasjonal tilknytning til gastrisk kreftrate. Gastroenterologi. 1994; 107: 1335-1344.
- Wolfe MM, Soll Ah. Fysiologien til magesyrehemmelighet. N English J Med 1998; 319: 1707.
- « G -cellers utvikling, gastrine, torv typosable kanaler
- Nanche -egenskaper, habitat, egenskaper, matlagingsoppskrifter »

