Silisiumhistorie, egenskaper, struktur, innhenting, bruker

- 4218
- 650
- Prof. Theodor Gran
Han silisium Det er et ikke -metallisk element og samtidig metalloid som er representert av det kjemiske symbolet hvis. Det er en halvleder, som er en essensiell del av datamaskiner, kalkulatorer, mobiltelefoner, solceller, dioder, etc.; Det er praktisk talt hovedkomponenten som har tillatt oppgjøret av den digitale tiden.
Silisium har alltid vært til stede i kvarts og silikater, begge mineraler som komponerer rundt 28% i masse av hele jordskorpen. Det er således det nest mest tallrike elementet på jordens overflate, og ørkenene og strendene og strendene gir et perspektiv på hvor rikelig det er.
 Ørkener er en rik naturlig kilde til silikapartikler eller granitter med andre mineraler. Kilde: Pxhere.
Ørkener er en rik naturlig kilde til silikapartikler eller granitter med andre mineraler. Kilde: Pxhere. Silisiumet tilhører gruppe 14 i det periodiske bordet, det samme som karbon, som ligger under dette. Det er grunnen til at dette elementet blir betraktet som en tetravalent metalloid; Den har fire elektroner av Valencia, og i teorien kan du miste dem alle for å danne kation hvis4+.
En eiendom som deler med kull er dens evne til å sammenkoble; Det vil si at atomene deres er koblet kovalent for å definere molekylkjeder. På samme måte kan silisium danne sine egne "hydrokarboner", kalt siltaner.
De dominerende forbindelsene av silisium i naturen er de berømte silikatene. I sin rene form kan det oppstå som et solid monokrystallinsk, polyristisk eller amorf. Det er et relativt inert fast stoff, så det representerer ikke betydelige risikoer.
[TOC]
Historie
Silisiumsteinen
Silisium er kanskje et av elementene som har hatt mest innflytelse på menneskehetens historie.
Dette elementet er hovedpersonen i steinalderen, og også av den digitale tiden. Opprinnelsen deres dateres tilbake da sivilisasjoner jobbet med kvarts og laget sitt eget glass; Og for øyeblikket er det hovedkomponenten i datamaskiner, bærbare datamaskiner og smarttelefoner.
Praktisk talt silisium har vært steinen fra to tidsepoker som er klart definert i vår historie.
Isolering
Da silikaen var så rikelig, et navn født av Flint Rock, måtte den inneholde et ekstremt rikt element i jordskorpen; Dette var den vellykkede mistanken om Antoine Lavoisier, som i 1787 mislyktes i hennes forsøk på å redusere det fra oksydet hennes.
En tid senere, i 1808, gjorde Humphry Davy sine egne forsøk og tildelte sitt fornavn til elementet: 'Silicium', som oversatte ville være som 'Pedernal Metal'. Det vil si at silisium da ble ansett som et metall på grunn av mangelen på karakterisering.
Da, i 1811, de franske kjemikerne Joseph l. Gay-Lussac og Louis Jacques Thénard klarte å tilberede amorf silisium for første gang. For dette reagerte de silisiumtetrafluorid med metallisk kalium. De renset imidlertid ikke eller karakteriserte produktet som ble oppnådd, så de konkluderte ikke med at det var det nye silikiumelementet.
Det var ikke annet enn i 1823 da den svenske kjemikeren Jacob Berzelius fikk et amorf silisium med tilstrekkelig renhet til å gjenkjenne det som silisium; Navn gitt i 1817 av den skotske kjemikeren Thomas Thomson når man vurderer det som et ikke -metallisk element. Berzelius gjennomførte reaksjonen mellom kalium og smeltet kaliumfluorosilikat for å produsere dette silisiumet.
Krystallinsk silisium
Den krystallinske silisium ble forberedt for første gang i 1854 av den franske kjemikeren Henry Deville. For å oppnå dette laget Deville en elektrolyse av en blanding av aluminium og natriumklorider, og oppnådde dermed silisiumkrystaller dekket av et lag med aluminiums siliciuro, som eliminerte (tilsynelatende) å vaske dem med vann med vann.
Fysiske og kjemiske egenskaper
Fysisk utseende
 Elementary silisium, som har en metallisk glans, men det er faktisk en metalloid. Kilde: Hi-res-bilder av kjemiske elementer [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Elementary silisium, som har en metallisk glans, men det er faktisk en metalloid. Kilde: Hi-res-bilder av kjemiske elementer [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Silisiumet i sin rene eller elementære form består av et blåaktig gråaktig eller svart fast stoff (overlegen bilde), som selv om det ikke er et metall, presenterer lyse ansikter som om det virkelig var.
Det er et hardt, men sprøtt fast stoff, som også viser en plateepitel hvis det dannes av Polyristales. På den annen side ser amorf silisium ut som et mørkebrunt pulverisert fast stoff. Takket være dette er det enkelt å identifisere og skille en type silisium (krystallinsk eller polyristisk) fra en annen (amorf).
Molmasse
28.085 g/mol
Atomnummer (z)
14 (14Ja)
Smeltepunkt
1414 ºC
Kokepunkt
3265 ºC
Tetthet
-Ved romtemperatur: 2,33 g/ml
-Rett ved smeltepunktet: 2,57 g/ml
Merk at flytende silisium er tettere enn solid silisium; Noe som betyr at krystallene deres vil flyte på en flytende fase, som med isvannssystemet. Forklaringen skyldes det faktum at det interatomiske rommet mellom atomene hvis det i glasset er større (mindre tett), enn tilsvarende i væsken (tettere).
Fusjonsvarme
50,21 kJ/mol
Fordampningsvarme
383 kJ/mol
Molar varmekapasitet
19.789 J/(mol · K)
Elektronegativitet
1.90 på Pauling -skalaen
Ioniseringsenergier
-Først: 786,5 kJ/mol
-Andre: 1577.1 KJ/Mol
-Tredje: 3231,6 kJ/mol
Atomisk radio
231 (målt i deres respektive diamantkrystaller)
Termisk ledningsevne
149 w/(m · k)
Elektrisk resistivitet
2.3 · 103 Ω · m til 20 ºC
Mohs hardhet
6.5
Sammenkobling
Silisiumatomer har evnen til å danne enkle Si-Si-koblinger, som ender opp med å definere en kjede (Si-si-si ...).
Denne eiendommen manifesteres også av karbon og svovel; SP -hybridiseringer3 av silisium er mer mangelfull sammenlignet med de to andre elementene, og i tillegg er deres 3P -orbitaler mer diffuse, så overlappingen av orbitalene SP3 resulterende er svakere.
Kan tjene deg: Eksotermiske og endotermiske reaksjonerGjennomsnittlige energier for Si-Si og C-C kovalente bindinger er henholdsvis 226 kJ/mol og 356 kJ/mol. Derfor er Si-hvis lenker svakere. På grunn av dette er ikke silisium hjørnesteinen i livet (heller ikke svovel). Faktisk er den lengste kjeden eller skjelettet som silisium kan danne seg vanligvis fire medlemmer (hvis4).
Oksidasjonstall
Silisiumet kan ha noen av følgende oksidasjonstall, forutsatt at i hver av dem eksistensen av ionene med sine respektive belastninger: -4 (ja4-), -3 (ja3-), -2 (ja2-), -1 (ja-), +1 (ja+), +2 (ja2+), +3 (ja3+) og +4 (ja4+). Av dem alle er -4 og +4 er de viktigste.
For eksempel antas -4 i Siliciuros (MG2Ja eller mg22+Ja4-); Mens +4 tilsvarer silisiumdioksyd (SIO2 eller hvis4+ENTEN22-).
Reaktivitet
Silisium er helt uoppløselig i vann, samt sterke syrer eller baser. Imidlertid løses det opp i en konsentrert blanding av nitrogen og fluorhoriske syrer (HNO3-Hf). På samme måte løses den opp i en varm alkalisk løsning, følgende kjemiske reaksjon som oppstår:
Ja (S) + 2NAOH (AC) + H2Eller (l) => na2Sio3(AC) + 2H2(g)
Natriummetasilikatet, na2Sio3, Det dannes også når silisium oppløses i smeltet natriumkarbonat:
Ja (S) + Na2Co3(L) => na2Sio3(L) + C (s)
Ved romtemperatur reagerer den ikke i det hele tatt med oksygen, ikke engang ved 900 ° C, når et SIIO -beskyttende glasslegemet begynner å dannes2; Og deretter, ved 1400 ° C, reagerer silisiumet med luftnitrogenet for å danne en blanding av nitrhures, uten og om3N4.
Silisium reagerer også ved høye temperaturer med metaller for å danne metall siliciuros:
2 mg (er) + ja (er) => mg2Ja (S)
2cu (er) + ja (er) => cu2Ja (S)
Ved romtemperatur reagerer den eksplosivt og direkte med halogener (det er ikke noe SIO -lag2 som beskytter det mot dette). For eksempel har du SIF -formasjonsreaksjonen4:
Ja (S) + 2F2(g) => sif4(g)
Og selv om silisium er uoppløselig i vannet, reagerer Red Alive med en dampstrøm:
Ja (S) + H2Eller (g) => si2(S) + 2H2(g)
Elektronisk struktur og konfigurasjon
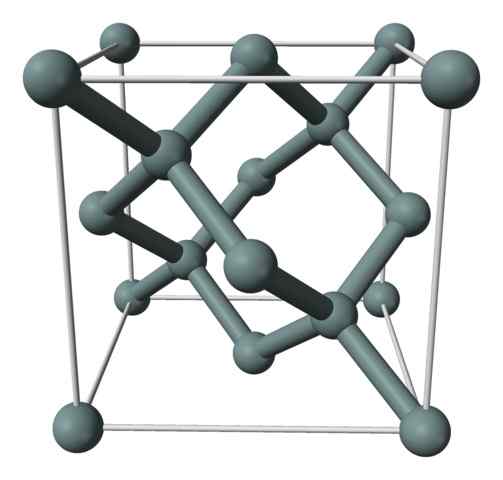 Krystallinsk struktur eller den enhetlige cellen til silisiumet representert med en modell av kuler og søyler. Kilde: Benjah-BMM27 [Public Domain]
Krystallinsk struktur eller den enhetlige cellen til silisiumet representert med en modell av kuler og søyler. Kilde: Benjah-BMM27 [Public Domain] Det øvre bildet viser den kubiske strukturen sentrert på ansiktene (FCC), det samme som diamant, for silisiumkrystall. De grå kulene tilsvarer atomene hvis de, som verdsatt, er kovalent knyttet til hverandre; I tillegg har de tetraedrale miljøer som reproduserer langs glasset.
Silisiumkrystallen er FCC fordi et atom blir observert hvis det er lokalisert på hvert av kubenes ansikter (6 × 1/2). Det er også åtte atomer hvis kubenes hjørner (8 × 1/8), og fire ligger inne i den (de som viser en godt definert tetrahedron rundt dem, 4 × 1).
Ovennevnte har hver enhetscelle totalt åtte silisiumatomer (3 + 1 + 4, tall angitt i avsnittet ovenfor); Karakteristikk som hjelper til med å forklare dens høye hardhet og stivhet, fordi rent silisium er en kovalent krystall så vel som diamant.
Kovalent karakter
Denne kovalente karakteren skyldes at silisium, i likhet med karbon, har fire valenselektroner i henhold til dens elektroniske konfigurasjon:
[NE] 3S2 3p2
For å koble, er Pure Orbitals 3s og 2p ubrukelige. Det er grunnen til at atomet skaper fire SP -hybride orbitaler3, Som du kan danne fire Si-si kovalente bindinger og på denne måten fullføre oktetten til Valencia for de to silisiumatomene.
Silisiumkrystallen blir deretter visualisert som et kovalent og tre -dimensjonalt nettverk sammensatt av sammenkoblet tetrahedra.
Imidlertid er dette nettverket ikke perfekt, siden det presenterer mangler og korngrenser, som skiller og definerer en krystall fra en annen; Og når slike krystaller er veldig små og tallrike, er det snakk om et polyristisk faststoff, identifisert av dets heterogene lysstyrke (ligner en svindlet mosaikk eller overflatesølv).
Elektrisk konduktivitet
Si-hvis lenker, med sine godt plasserte elektroner, i prinsippet er uenig i hva som forventes av et metall: et hav av elektroner som "fukting" deres atomer; I det minste er dette slik at romtemperatur.
Når temperaturen øker, begynner imidlertid silisium å drive strøm og oppfører seg derfor som et metall; Det vil si at det er et halvledermetalloidelement.
Amorf silisium
Silisium -tetrahedere tar ikke alltid et strukturelt mønster, men kan ordnes på en uordnet måte; Og til og med, med silisiumatomer hvis hybridiseringer ser ut til å være SP3 Men sp2, som bidrar til å øke forstyrrelsesgraden ytterligere. Derfor er det snakk om et amorf og ikke -krystallinsk silisium.
I amorft silisium er det elektroniske ledige stillinger, der noen av atomene deres har en orbital med et elektron forsvunnet. Takket være dette kan det faste stoffet hydrogenet seg selv, noe som gir opphav til dannelse av hydrogenalt amorf silisium; det vil si at den har Si-H-koblinger, som tetrahedra er fullført i uordnede og vilkårlige posisjoner.
Kan tjene deg: interatomiske lenkerDenne delen avsluttes deretter med å si at silisium kan presenteres i tre typer faste stoffer (for ikke å nevne graden av renhet): krystallinsk, polyristalin og amorf.
Hver av dem har sin egen metode eller produksjonsprosess, så vel som den.
Hvor er det og skaffer seg
 Kvartskrystaller (silika) er en av de viktigste og mest ekstraordinære mineralene der silisium ligger. Kilde: James St. John (https: // www.Flickr.com/bilder/jSjgeology/22437758830)
Kvartskrystaller (silika) er en av de viktigste og mest ekstraordinære mineralene der silisium ligger. Kilde: James St. John (https: // www.Flickr.com/bilder/jSjgeology/22437758830) Silisium er det syvende mest tallrike elementet i universet, og det andre i jordskorpen, og beriker også jordens mantel med sin enorme mineraler. Dette elementet assosieres ekstraordinært godt med oksygen, og danner et bredt spekter av oksider; Blant dem, silika, så2, og silikater (mangfoldig kjemisk sammensetning).
Silika kan sees med det blotte øye i ørkenene og strendene, fordi sanden hovedsakelig er sammensatt av Sio2. På sin side kan dette oksydet manifestere seg i noen få polymorfer, og være det vanligste: kvarts, ametyst, agate, christobalite, tripoli, coesite, stishovita og tundimita. I tillegg kan det finnes i amorfe faste stoffer som opaler og diatoma -land.
Silikatene er i mellomtiden enda rikere strukturelt og kjemisk. Blant noen av de silikatiske mineralene kan nevnes: asbest (hvit, kaffe og blåaktig), feltspat, leire, mykier, oliven, aluminosilikater, zeolitter, amfibe og pyroxener.
Rent praktisk er alle bergarter sammensatt av silisium og oksygen, med sine Si-O stabile bindinger, og deres silikater og silikater blandet med metalloksider og uorganiske arter.
-Silika reduksjon
Problemet som representerer å skaffe silisium er å bryte denne Si-O-lenken, som spesielle ovner og en god reduksjonsstrategi er nødvendig. Råstoffet til denne prosessen er kvarts -formet silika, som tidligere beveger seg til det er et fint pulver.
Fra denne bakken kan den fremstilles enten ved amorf silisium eller polyristalin.
Amorf silisium
I liten skala, laget i et laboratorium og med de relevante tiltakene, blandes silikaen med magnesiumstøv i en smeltedigel og blir forbrent i fravær av luft. Neste reaksjon finner sted da:
Sio2(S) + mg (er) => 2mgo (er) + ja (s)
Magnesium og oksid elimineres med en fortynnet saltsyreoppløsning. Deretter behandles det gjenværende faste stoffet med fluorhorsyre, slik at det avsluttes reagerer SIO2 i overkant; Ellers favoriserer overflødig magnesium dannelsen av dens respektive siliciuro, MG2Ja, uønsket forbindelse for prosessen.
Sio2 Det forvandles til Sif flyktig gass4, som utvinnes for annen kjemisk syntese. Til slutt tørkes den amorfe silisiumdeigen under en gasshydrogenstrøm.
En annen lignende metode for å oppnå amorf silisium er å bruke samme SF4 tidligere produsert, eller SICL4 (tidligere ervervet). Dampene til disse silisiumhalogenuroene føres over flytende natrium i en inert atmosfære, slik at reduksjon av gass kan gis uten tilstedeværelse av oksygen:
Sicl4(g) + 4na (l) => ja (er) + 4naCl (l)
Interessant nok, med amorf silisium, produseres solcellepaneler med høy energi.
Krystallinsk silisium
Fra og med fra pulverisert silika eller kvarts blir de ført til en elektrisk bueovn, der den reagerer med koks. På denne måten er det reduserende middelet ikke lenger et metall, men et karbonholdig materiale med høy renhet:
Sio2(S) + 2C (S) => Ja (S) + 2CO (G)
I reaksjonen produseres også silisiumkarbid, SIC, som er nøytralisert med et overskudd av SIO2 (Igjen er kvarts i altfor):
2SIC (S) + SIO2(S) => 3SI (S) + 2CO (G)
En annen metode for å fremstille krystallinsk silisium bruker aluminium som et reduserende middel:
3SIO2(S) + 4al (L) => 3SI (S) + 2AL2ENTEN3(S)
Og starter fra kaliumheksafluorurosilikatet, k2[Sif6], den reagerte også med metallaluminium eller kalium for å forårsake det samme produktet:
K2[Sif6] (l) + 4al (l) => 3Si (s) + 6kf (l) + 4alf3(g)
Umiddelbart løses silisiumet opp i smeltet aluminium, og når systemet avkjøles, krystalliserer og skiller det første fra det andre; det vil si at silisiumkrystaller dannes, som ser gråaktige farger.
Polyristalin silisium
I motsetning til den andre syntesen eller produksjonene, for å oppnå polyristisk silisium, begynner det med en Silano gassfase, SIH4. Denne gassen gjennomgår en pyrolyse over 500 ° C, på en slik måte at en termisk nedbrytning oppstår, og dermed den første vaporene, ender de opp med å avsette silisiumpolyristaler på en halvlederoverflate.
Følgende kjemiske ligning eksemplifiserer reaksjonen som finner sted:
Ja H4(g) => ja (er) + h2(g)
Det er klart det ikke skal være noe oksygen i kammeret, da det ville reagere med SIH4:
Ja H4(g) + 22(g) => Sio2(S) + 2H2O (g)
Og spontaniteten i forbrenningsreaksjonen er slik, som skjer raskt ved romtemperatur i ansiktet.
Nok en syntetisk rute for å produsere denne typen silisiumdel av det krystallinske silisiumet som råstoff. De får det til å reagere med hydrogenklorid ved en temperatur rundt 300 ° C, slik at triklorosilano dannes:
Kan tjene deg: jern (element): egenskaper, kjemisk struktur, brukJa (S) + 3HCl (G) => SICL3H (g) + h2(g)
Og sicl3H reagerer på 1100 ºC for å regenerere silisium, men nå polyristalin:
4Sicl3H (g) => ja (er) + 3sicl4(g) + 2H2(g)
Det er nok å se ligningene for å gi en ide om arbeid og strenge produksjonsparametere som må vurderes.
Isotoper
Silisium er naturlig og hovedsakelig som isotopen 28Ja, med en overflod på 92,23%.
I tillegg til dette er det to andre isotoper som er stabile og derfor ikke lider radioaktivt forfall: 29Ja, med en overflod på 4,67%; og 30Ja, med en overflod på 3,10%. Å være så rik 28Ja, det er ikke overraskende at atomvekten til silisiumet er 28.084 u.
Silisiumet kan også være i flere radioisotoper, blant dem 31Ja (t1/2= 2,62 timer) og 32Ja (t1/2= 153 år). Andre (22Ja - 44Hvis de har det t1/2 Veldig kort eller kort (mindre enn hundrelapper på sekunder).
Risiko
Rent silisium er et relativt inert stoff, så det samler seg vanligvis ikke i noe organ eller vev så lenge eksponeringen for det er lav. I støvform kan det forårsake øyiske irritasjoner, forårsake tårer eller rødhet, mens det å berøre det kan forårsake ubehag i huden, kløe og skrelle.
Når eksponeringen er veldig høy, kan silisium skade lungene; Men uten påfølgende effekter, med mindre mengden er nok til å forårsake kvelning. Dette skjer imidlertid ikke med kvarts, som er assosiert med lungekreft og sykdommer som bronkitt og emfysem.
På samme måte er rent silisium veldig sjelden natur, og forbindelsene, så rikelig i jordskorpen, representerer ikke noen risiko for miljøet.
Nå, med hensyn til organene, kan disse være giftige; Men å ha mange av dem avhengige av hvilken som blir vurdert, så vel som andre faktorer (reaktivitet, pH, virkningsmekanisme, etc.).
applikasjoner
Anleggsbransjen
Silisiummineraler integrerer "steinen" som bygninger, hus eller monumenter er bygget. For eksempel består sement, betong, stukk. Fra denne tilnærmingen kan man fremstå som verktøyet som dette elementet har i byer og arkitektur.
Glass og keramikk
Fra silikaen kan krystaller brukt på optiske enheter produseres, enten det er som isolatorer, celler for spektrofotometre prøver, piezoelektriske krystaller eller bare briller.
Når materialet er fremstilt med flere tilsetningsstoffer, ender det opp med å forvandle seg til et amorft fast stoff, godt kjent som glass; og fjell av sand er vanligvis kilden til silisiumdioksyd eller kvarts som er nødvendig for dens produksjon. På den annen side, med silikatene, produseres keramiske og porselensmaterialer.
Sammenflettede ideer, silisium er også til stede i håndverk og ornamentasjoner.
Legeringer
Silisiumatomer kan være sammenhengende og være blandbare med en metallmatrise, så det er et tilsetningsstoff for mange legeringer eller metaller; For eksempel stål, for å produsere magnetiske kjerner; Bronzes, for fremstilling av telefonkabler; og aluminium, i produksjonen av aluminium-Sailicio-legering for lette bildeler.
Derfor kan det ikke bare finnes i "steinen" av bygninger, men også i metallene i søylene deres.
Tørkemidler
 Gelatinøse silikakuler, brukt som tørkemidler. Kilde: Tørkemidler [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Gelatinøse silikakuler, brukt som tørkemidler. Kilde: Tørkemidler [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Silika, i form av gel eller amorf, gjør det mulig å produsere faste stoffer som fungerer som tørkemidler når du fanger vannmolekylene som kommer inn.
Elektronisk industri
 Polyristal og amorf silisium brukes til fremstilling av solcellepaneler. Kilde: Pxhere.
Polyristal og amorf silisium brukes til fremstilling av solcellepaneler. Kilde: Pxhere. Silisiumlag med forskjellige tykkelser og farger er en del av datamaskinbrikker, så vel som med deres faste (krystallinske eller amorfe), integrerte kretsløp og solceller er designet.
Å være halvleder, er atomer inkorporert med mindre (Al, B, GA) eller flere elektroner (P, AS, SB) for å transformere det til type halvledere p enten n, henholdsvis. Med to silikiosforeninger, en n og den andre p, Dioder med lysutsendere er produsert.
Silikonpolymerer
Det berømte silikonlimet består av en organisk polymer som støttes av stabiliteten til kjedene til Si-O-Si-koblingene ... Hvis disse kjedene er veldig lange, korte eller tverrbundne, endres egenskapene til silikonpolymerendringen, så vel som deres Endelige applikasjoner.
Blant bruken kan følgende nevnes nedenfor:
-Lim eller lim, ikke bare for å slå sammen papirer, men byggeblokker, gummi, glasspaneler, steiner, etc.
-Smøremidler i hydrauliske bremsesystemer
-Forsterker maleriene og forbedrer lysstyrken og intensiteten i fargene sine, samtidig som lar deg motstå temperaturendringer uten sprekker eller Carcome
-De brukes som vannavvisende spray, som forblir tørre noen overflater eller gjenstander
-De gir personlige hygieneprodukter (tannpasta, sjampo, geler, barberhøvelkremer osv.) Følelsen av å være silkeaktig
-Beleggene beskytter de elektroniske komponentene til delikate enheter mot varme og fuktighet, for eksempel mikroprosessorer
-Med silikonpolymerer blir flere av gummikulene som spretter knapt falt ned på gulvet.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Silisium. Hentet fra: i.Wikipedia.org
- Mikrokjemikalier. (s.F.). Krystallografi av silisium. Gjenopprettet fra: Mikrokjemikalier.com
- Lentech b.V. (2019). Periodebord: silisium. Gjenopprettet fra: Lentech.com
- Marques Miguel. (s.F.). Silisium oppstår. Gjenopprettet fra: Nautilus.Fis.Uc.Pt
- Mer hemant. (5. november 2017). Silisium. Gjenopprettet fra: Hemantmore.org.i
- Pilgaard Michael. (22. august 2018). Silisium: Forekomst, isolasjon og syntese. Gjenopprettet fra: Pilgaardelegs.com
- Dr. Doug Stewart. (2019). Fakta om silisiumelement. Chemicool. Gjenopprettet fra: Chemicool.com
- Christiana Honsberg og Stuart Bowden. (2019). En samling av ressurser for den fotovoltaiske pedagogen. Pveducation. Hentet fra: Pveducation.org
- American Chemistry Council, Inc. (2019). Silikoner i hverdagen. Gjenopprettet fra: SEHSC.Americachemistry.com

