Titanoksyd (IV) struktur, egenskaper, bruker

- 4293
- 1251
- Jonathan Carlsen
Han Titanoksid (IV) Det er et krystallinsk hvitt uorganisk fast stoff hvis kjemiske formel er onkel2, Så det er også kjent som titandioksid. Eksisterer i tre krystallinske former: Rutilo, Anatasa og Brookita. Selv om det i naturen vanligvis er farget på grunn av tilstedeværelsen av urenheter som jern, krom eller vanadium, onkelen2 ren brukes som et hvitt pigment.
Blant dens egenskaper kan vi fremheve at onkelenes løselighet2 Det avhenger betydelig av den kjemiske og termiske historien. Så vel som det når den blir oppvarmet til høye temperaturer (900 ºC) blir den kjemisk inert. De viktigste kildene er ilmenitt (jern og titanoksid), rutilo og anatase.
 Titandioksidstøv. Den opprinnelige opplasteren var Walkerma på engelsk Wikipedia. [Offentlig domene]
Titandioksidstøv. Den opprinnelige opplasteren var Walkerma på engelsk Wikipedia. [Offentlig domene] Det forekommer hovedsakelig i tilstrekkelig grad for bruk som pigment, som garanterer dets utmerkede lysdispersjonsegenskaper i applikasjoner som krever hvit opacitet og lysstyrke.
Det forekommer også som ultrafinmateriale, for applikasjoner der det kreves åpenhet og maksimal absorpsjon av ultrafiolette stråler (UV). For eksempel som en komponent av solkremer for huden. I disse, onkelen2 Det fungerer som et filter, og blokkerer dermed absorpsjonen av disse strålene.
På grunn av dets kjemiske treghet er det det foretrukne hvite pigmentet. Imidlertid USAs Food and Drug Administration, eller FDA (forkortelse for engelsk ELLER.S. Food and Drug Administration), har etablert parametrene for sikker bruk i mat og kosmetikk.
Det er også en eksponeringsgrense for titanoksidstøv, siden når støvet inhaleres, kan det avsettes i lungene.
Det kan tjene deg: kalsogener eller amfumoer[TOC]
Struktur
Onkelen2 Den har tre krystallinske modifikasjoner: Rutilo, Anatasa og Brookita. Disse krystallinske variantene er alle i naturen.
Rutilo
Rutho krystalliserer seg i det tetragonale systemet med to enheter TIO2 for hver celle. Titan er koordinert octaékonisk. Det har blitt demonstrert av kalorimetriske studier at Rutilo er den mest stabile krystallinske formen.
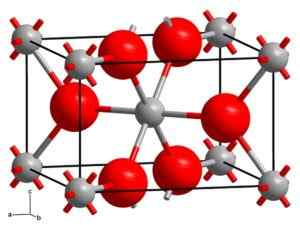 Krystallinsk struktur av Rutilo. Grå baller: titan, rosa baller: oksygen. Solid State [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Kilde: Wikipedia Commons
Krystallinsk struktur av Rutilo. Grå baller: titan, rosa baller: oksygen. Solid State [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Kilde: Wikipedia Commons Anatasa
Denne formen krystalliseres i det tetragonale systemet, men anatasen presenteres i form av veldig forvrengte oktom av oksygenatomer med hensyn til hvert titanatom, to av dem er relativt nærmest. Har 4 enheter onkel2 For hver krystallinsk celle.
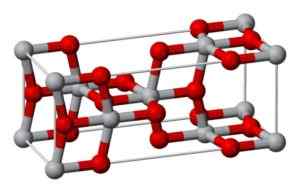 Krystallinsk struktur av anatasen. Benjah-BMM27 [Public Domain] Kilde: Wikipedia Commons
Krystallinsk struktur av anatasen. Benjah-BMM27 [Public Domain] Kilde: Wikipedia Commons Brookita
Krystalliserer i det ortorrombiske systemet, med 8 enheter TIO2 For hver krystallinsk celle.
Egenskaper
Fysisk tilstand
Krystallinsk fast.
Mohs hardhet
Rutilo: 7-7.5.
Anatasa: 5.5-6.
Molekylær vekt
79,87 g/mol.
Smeltepunkt
Rutilo: 1830-1850 ºC.
Anatasa: Når oppvarming blir rutilo.
Tetthet
Rutilo: 4.250 g/cm3
Anatasa: 4133 g/cm3
Brookita: 3.895 g/cm3
Løselighet
Uoppløselig i vann og organiske løsningsmidler. Det oppløses sakte i HF og H2SW4 Varmt konsentrat. Uoppløselig i HCl og HNO3.
Ph
7.5.
Brytningsindeks
Rutilo: 2,75 til 550 nm.
Anatasa: 2,54 til 550 nm.
Den har den høyeste brytningsindeksen for alle uorganiske pigmenter.
Andre egenskaper
Anatase transformeres raskt til rutilo ved temperaturer over 700 ºC. Onkelen2 som er blitt kalsinert ved 900 ° C oppløses svakt i baser, fluorhorisk syre og varm svovelsyre. Det blir ikke angrepet av svake uorganiske syrer eller organiske syrer. Det reduseres ikke lett eller oksidert.
Det kan tjene deg: Scandio: Historie, egenskaper, reaksjoner, risikoer og bruksområderAnatase og Rutil.
Nomenklatur
-Titandioksid
-Rutilo
-Anatasa
-Brookita
-Titania
applikasjoner
Hvite pigmenter
Den viktigste bruken av titanoksyd (IV) er som hvitt pigment i et bredt utvalg av produkter, som inkluderer maling, lakk, lim, plast, papir og utskriftsblekk. Dette skyldes den høye brytningsindeksen og den kjemiske tregheten.
 Kilde: Pexels.com
Kilde: Pexels.com Titandioksid brukt som hvitt pigment må ha høy renhet. Dens opacitet og lysstyrke stammer fra dens evne til å spre lyset. Er lysere enn diamanten. Bare Rutilo og Anatase har gode pigmenteringsegenskaper.
Plast
I plasten onkelen2 Minimerer skjørhet og sprekker som kan oppstå som et resultat av eksponering for lys.
Det er det viktigste pigmentet i fremstilling av utvendige PVC -plastgjenstander, fordi det gir UV -beskyttelse til materialet.
Den optimale krystallinske formen i dette tilfellet er Rutilo. I denne applikasjonen må rutiloen ha et overflatebelegg av zirkonium, silika eller aluminium, for å minimere den fotokatalytiske effekten av onkelen2 I PVC -nedbrytning.
Andre bruksområder
Andre bruksområder inkluderer glassfartsemaljer brukt i smeltet stål og jern, som gir opacitet og syremotstand.
I tekstilindustrien brukes den i trådguidene, slik at de lett glir under garnet. Friksjon mellom tråder og guider genererer statisk elektrisitet. For å spre det, onkelen2 Det må brennes ved 1300 ºC, for å ha større elektrisk ledningsevne.
Kan tjene deg: litiumfluor: struktur, egenskaper, innhenting, brukAndre applikasjoner inkluderer blekkpigmentering for utskrift. Som papirbelegg, onkelen2 Det gjør det hvitere, lyse og mer ugjennomsiktig.
Det brukes i kosmetikk for å dekke hudens ufullkommenheter, samt for å gi hvit tannkrem og såpe.
Det gjør det mulig å beskytte mat, drikke, kosttilskudd og farmasøytiske produkter mot for tidlig nedbrytning produsert av effekten av lys, og forlenger produktets levetid.
Det er en komponent i produksjonen av glass, keramikk og elektroceramisk. Det brukes i elektriske kretselementer. Det brukes også i oksygenføleren til eksosanlegget til motorvogner.
Onkelen2 Ultrafino brukes som en komponent av solblokkere, siden det er en sterk absorberende av ultrafiolette stråler (UV), både UV-A og UV-B. UV-A-stråler forårsaker rynker og aldring av huden, og UV-B forårsaker forbrenning og erytem.
Nanopartiklene til onkel2 De brukes som kjemiske reaksjoner katalysatorstøttemateriale.
Anatase er en fotokatiserende effektiv som oksiderer organiske forbindelser. Mens mindreårige er dens partikler, jo mer effektive er det.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. John Wiley & Sons.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Volum 19 og 24. Fjerde utgave. John Wiley & Sons.
- Kjemiske sikkerhetsfakta. (2019). Titandioksid. Gjenopprettet fra: ChemicalSafetyFacts.org
- Wypych, George. (2015). PVC -tilsetningsstoffer. I PVC Formulary (Second Edition). Gjenopprettet fra Scientedirect.com
- Denning, r. (2009). Forbedre ullprodukter ved bruk av nanoteknologi. I fremskritt innen ullteknologi. Gjenopprettet fra Scientedirect.com
- National Library of Medicine. (2019). Titandioksid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- « Skjoldbruskprofilfunksjon av hormoner, betydning, kvantifisering
- Chulachaqui -egenskaper og legende »

